题目内容
11.某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.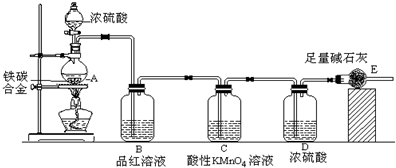
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;②常温下Fe遇浓硫酸发生钝化.
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)B中的现象是:品红溶液褪色;C的作用是:除尽反应产物中的SO2气体.
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.则铁碳合金中铁的质量分数为$\frac{11m-3b}{11m}$(写化简后的表达式).
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:装置内的CO2难以赶尽,导致E质量增重偏小
(6)最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低是(任答一条即可)SO2不一定能全部被品红KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O等.
分析 由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下碳与浓硫酸不反应,铁在浓硫酸中发生钝化现象;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;
二氧化硫存在会影响二氧化碳的质量测定,C装置的作用为除尽反应产物中的SO2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒计算合金中碳元素的质量,合金的质量减去碳元素质量等于铁的质量,再根据质量分数定义计算;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小;
(6)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等.
解答 解:由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)常温下,铁与浓硫酸反应生成一层致密的氧化物保护膜,阻止内金属继续与浓硫酸反应,发生钝化现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使品红溶液褪色;C装置的作用为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)E增重b g为二氧化碳的质量,根据碳元素守恒可知合金中碳元素的质量为$\frac{12}{44}$bg,合金中铁的质量为mg-$\frac{12}{44}$bg=(m-$\frac{3}{11}$b)g,故铁的质量分数$\frac{m-\frac{3b}{11}}{m}$=$\frac{11m-3b}{11m}$,
故答案为:$\frac{11m-3b}{11m}$;
(5)装置内残留部分二氧化碳,未能被装置E完全吸收,导致测量的二氧化碳的质量偏小,即合金中碳元素的质量偏小,铁元素的质量增大,质量分数增大,
故答案为:装置内的CO2难以赶尽,导致E质量增重偏小;
(6)由装置图可知,SO2不一定能全部被品红KMnO4除去,E中碱石灰会吸收空气中的CO2、H2O等,
故答案为:SO2不一定能全部被品红KMnO4除去或E中碱石灰会吸收空气中的CO2、H2O等.
点评 本题考查学生对实验原理的理解、对实验方案与实验装置的评价、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 蔗糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 纤维素 |
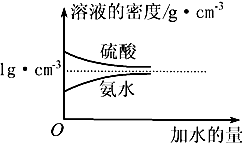 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等质量混合,所得溶液的质量分数为$\frac{{w}_{1}}{2}$,物质的量浓度大于 c1/2mol•L-1(填“大于”、“小于”或“等于”,下同).
(3)质量分数为w2的氨水与3w2的氨水等质量混合,所得溶液的密度小于ρ2 g•cm-3.
| A. | 胶体区别于其它分散系的本质特性是丁达尔效应 | |
| B. | 利用半透膜可除去淀粉溶液中的少量NaCl | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 胶体能产生丁达尔效应的原因是胶粒使光线发生了折射 |
| A. | K+、H+、HCO3- | B. | Cu2+、Na+、OH- | C. | Na+、Cl-、NO3- | D. | Ag+、Cl-、SO42- |
