题目内容
【题目】2,3-二氢呋喃(![]() )可用于电子化学品和香料中,其合成路线如下:
)可用于电子化学品和香料中,其合成路线如下:
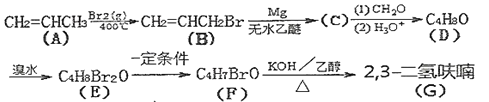
已知:
回答下列问题:
(1)A→B的反应类型为___________。
(2)A的名称为___________;B所含官能团的名称为___________。
(3)写出E的结构简式______________________。
(4)写出F→G的化学方程式______________________。
(5)满足下列条件的F的同分异构体共有___________种。
①含![]() ; ②不含环状结构 ; ③不考虑立体异构。
; ②不含环状结构 ; ③不考虑立体异构。
(6)写出符合下列条件的D的同分异物体的结构简式___________。
①能发生银镜反应。②核磁共振氢谱有三种峰且峰面积之比为6︰1︰1。
(7)写出用1,3-丁二烯为原料制备四氢呋喃(![]() )的合成路线_____________________(无机试剂任选)。
)的合成路线_____________________(无机试剂任选)。
【答案】取代反应 丙烯 碳碳双键 溴原子 ![]()
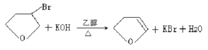 10
10 ![]()
![]()
【解析】
根据![]() ,
,![]() ,可知C是
,可知C是![]() ;根据
;根据 ,可知
,可知![]()
![]() ,D是
,D是![]() ;
;![]() 与溴水发生加成反应生成E,E是
与溴水发生加成反应生成E,E是![]() ;F在KOH的醇溶液中发生消去反应生成
;F在KOH的醇溶液中发生消去反应生成![]() ,逆推F是
,逆推F是![]() 。
。
根据以上分析,(1)![]() 是溴原子取代了
是溴原子取代了![]() 甲基上的1个氢原子,所以A→B的反应类型为取代反应。
甲基上的1个氢原子,所以A→B的反应类型为取代反应。
(2)![]() 的名称为丙烯;
的名称为丙烯;![]() 含官能团的名称为碳碳双键、溴原子。
含官能团的名称为碳碳双键、溴原子。
(3) ![]() 与溴水发生加成反应生成E, E的结构简式是
与溴水发生加成反应生成E, E的结构简式是![]() 。
。
(4) ![]() 在KOH的醇溶液中发生消去反应生成
在KOH的醇溶液中发生消去反应生成![]() ,化学方程式
,化学方程式 。
。
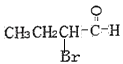
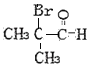
(5)F的同分异构体满足;①含![]() ;②不含环状结构;③不考虑立体异构。F的同分异构体共有
;②不含环状结构;③不考虑立体异构。F的同分异构体共有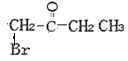 、
、 、
、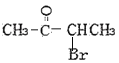 、
、 、
、 、
、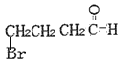 、
、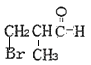 、
、 、
、![]() 、
、 ,共10种。
,共10种。
(6)①能发生银镜反应说明含有醛基。②核磁共振氢谱有三种峰且峰面积之比为6︰1︰1的D的结构简式是![]() 。
。
(7) 1,3-丁二烯与溴发生1,4加成,生成![]() ,
,![]() 水解为
水解为![]() ,
,![]() 在浓硫酸作用下发生分之内脱水生成
在浓硫酸作用下发生分之内脱水生成![]() ;合成路线为
;合成路线为![]() 。
。

【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
【题目】中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定,则在操作过程中正确的顺序是__________________。(写序号)
(2)排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)选用的指示剂是_____________________ 。(a、石蕊 b、酚酞)
(4)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(5)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(6)请根据下表中数据计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= ________________。(精确到小数点后四位)
滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
第一次 | 25.00 | 0.00 | 26.10 | 26.10 |
第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(7)滴定终点的判定依据是_____________________________________________。
【题目】用如图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
