题目内容
【题目】下列元素中,原子半径最大的是( )
A.Na
B.Mg
C.Al
D.Si
【答案】A
【解析】解:Na、Mg、Al、Si四种元素属于同周期元素,同周期元素自左而右原子半径减小,故原子半径Na>Mg>Al>Si,所以Na的原子半径最大,故A正确;
故选A.
【考点精析】解答此题的关键在于理解微粒半径大小的比较的相关知识,掌握同周期元素的原子或最高价离子半径从左到右逐渐减小(稀有气体元素除外);电子层数相同,核电荷数越大半径越小;核电荷数相同,电子数越多半径越大;电子数和核电荷数都不同的,一般通过一种参照物进行比较;具有相同电子层结构的离子,一般是原子序数越大,离子半径越小.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】探究Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O 反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶 | 0.1molLNa2S2O3 溶液/mL | 蒸馏水 | 0.2mol/L H2SO4 溶液 | 反应温度 | 浑浊出现时间/s | 备注 |
1 | 10 | 0 | 10 | 20℃ | 10 | |
2 | 10 | 5 | 5 | 20℃ | 16 | |
3 | 10 | 0 | 10 | 50℃ | 5 | 第10 秒开始浑浊不再增多 |
4 | 10 | 6 | 4 | 50℃ | 8 |
A. 该反应也可通过测SO2的体积变化来表示化学反应速率的快慢
B. 3号瓶用Na2S2O3 来表示速率为0.0lmol/(Ls)
C. 由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D. 由1号瓶和4号瓶实验结果可得温度越高反应速率越快
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②分析数据可知:现代工业生产不采用“大气固氮”原理的原因:_______。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因______________。
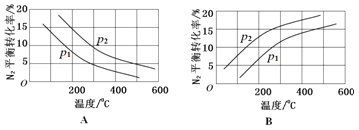
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是____(填“A”或“B”);比较P1、P2的大小关系_______。
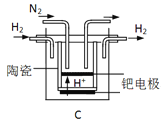
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是__________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H=________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1)
2H2O(l) △H=-571.6kJ·mol-1)
