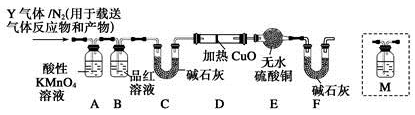
题目内容
N、O、Si、S是重要的非金属元素,下列说法正确的是
| A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱 |
| B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质 |
| C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
| D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2 |
C
解析试题分析:A、同周期自左向右,原子半径逐渐减小,非金属性逐渐增强。同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,所以原子半径是Si>S>N>O,非金属性是O>N>S>Si,A不正确;B、硫的氧化物不能形成光化学烟雾,B不正确;C、S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,S、SO2都能和硝酸反应,Si和SiO2都能和氢氟酸反应,C正确;D、氮气和氧气反应生成物是NO,D不正确,答案选C。
考点:考查常见非金属元素及其化合物的性质、原子半径大小比较、大气污染等

碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O ③ 2H2S + 3O2 → 2SO2 + 2H2O
| A.①②③ | B.③①② | C.①③② | D.③②① |
下列关于硅元素的说法,不正确的是
| A.光导纤维的主要成分是二氧化硅 | B.二氧化硅可以和水直接反应来制取硅酸 |
| C.硅可用作太阳能电池 | D.硅酸钠是制备硅胶和木材防火剂等的原料 |
稀硫酸中插一块铜片,加入下列物质后,可使铜片发生反应的是 ( )
| A.稀盐酸 | B.硫酸钠晶体 | C.硝酸钾晶体 | D.氯化钠晶体 |
下列陈述正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式: 。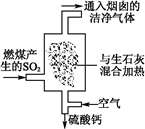
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示: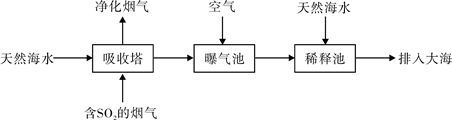
①向曝气池通入空气的目的是 。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是 。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |