题目内容
【题目】一种利用失活的含镍催化剂(含NiB、MgO及SiO2等)为原料制备超细镍粉,其工艺流程如下:
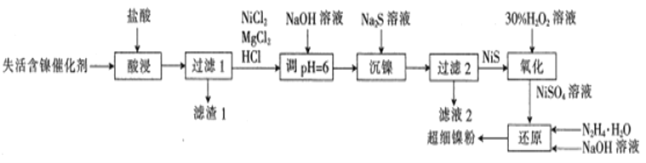
已知:pH=6时,Mg2+、Ni2+都不生成沉淀。
回答下列问题:
(1)非晶态NiB可由KBH4和Ni(NO3)2溶液反应制备。KBH4的电子式为_________
(2)“酸浸”时,为提高镍的浸取率可采取的措施是___________ (列举一点);滤值1中除了含有B单质外,还含有___________ (填化学式)。
(3)若流程中没有“NaOH溶液调pH=6”,则导致的后果是________
(4)“氧化”时发生反应的化学方程式为_______________;氧化时温度不宜超过50℃,其原因是_________________
(5)“还原”时产生无污染的气体,“还原”时发生反应的离子方程式为___________
【答案】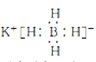 碎失活的含镍催化剂,增大反应物的接触面积或增大盐酸的浓度(或用量)或适当延长浸取时间或搅拌(或振荡)等 SiO2 会产生大量硫化氢气体,污染环境 NiS+4H2O2=NiSO4+4H2O 减少过氧化氢分解损失 2Ni2++N2H4·H2O+4OH—=2Ni↓+N2↑+4H2O
碎失活的含镍催化剂,增大反应物的接触面积或增大盐酸的浓度(或用量)或适当延长浸取时间或搅拌(或振荡)等 SiO2 会产生大量硫化氢气体,污染环境 NiS+4H2O2=NiSO4+4H2O 减少过氧化氢分解损失 2Ni2++N2H4·H2O+4OH—=2Ni↓+N2↑+4H2O
【解析】
向失活的含镍催化剂中加入盐酸,NiB溶于盐酸生成Ni2+和B,MgO溶于盐酸生成Mg2+,SiO2与盐酸不反应,过滤,得到含有Ni2+和Mg2+的溶液和含有B单质和SiO2的滤渣;向滤液中加入NaOH溶液pH为6,再加入Na2S溶液,Na2S溶液与Ni2+反应生成NiS沉淀,过滤得到NiS沉淀;向NiS沉淀中加入30%过氧化氢溶液,NiS沉淀与过氧化氢溶液反应生成硫酸镍和水;向溶液中继续加入N2H4·H2O和氢氧化钠溶液,硫酸镍和N2H4·H2O碱性条件下发生氧化还原反应生成超细镍粉。
(1)KBH4是由K+和BH4—组成的离子化合物,电子式为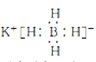 ,故答案为:
,故答案为: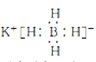 ;
;
(2)“酸浸”时,为提高镍的浸取率,可粉碎失活的含镍催化剂,增大反应物的接触面积或增大盐酸的浓度(或用量)或适当延长浸取时间或搅拌(或振荡)等;向失活的含镍催化剂中加入盐酸,NiB溶于盐酸生成Ni2+和B,MgO溶于盐酸生成Mg2+,SiO2与盐酸不反应,过滤得到的滤渣1中除了含有B单质外,还含有SiO2,故答案为:碎失活的含镍催化剂,增大反应物的接触面积或增大盐酸的浓度(或用量)或适当延长浸取时间或搅拌(或振荡)等;SiO2;
(3)若流程中没有“NaOH溶液调pH=6”,加入Na2S溶液时,Na2S溶液会与氢离子反应生成有毒的硫化氢气体,污染空气,故答案为:会产生大量硫化氢气体,污染环境;
(4)“氧化”时,,NiS沉淀与过氧化氢溶液反应生成硫酸镍和水,反应的化学方程式为NiS+4H2O2=NiSO4+4H2O,故答案为:NiS+4H2O2=NiSO4+4H2O;因过氧化氢受热易分解生成氧气和水,则氧化时温度不宜超过50℃,故答案为:NiS+4H2O2=NiSO4+4H2O;减少过氧化氢分解损失;
(5)“还原”时,硫酸镍和N2H4·H2O碱性条件下发生氧化还原反应生成超细镍粉,反应的离子方程式为2Ni2++N2H4·H2O+4OH—=2Ni↓+N2↑+4H2O,故答案为:2Ni2++N2H4·H2O+4OH—=2Ni↓+N2↑+4H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案