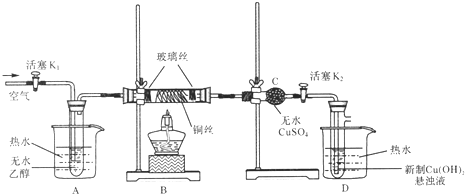
题目内容
【题目】(Ⅰ)某化学反应A![]() B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应属于__________反应(填“可逆”或“不可逆”)。
(2)在实验1、2中,有一个实验使用了催化剂。请你利用表中数据判断实验___(填1或2)使用了催化剂,理由是_______________。
(3)该实验表明,影响化学反应速率的因素还有__________。
(II)下图是1molNO2和1molCO反应生成1molCO2和1molNO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________。

该反应的活化能等于____________________
【答案】可逆 2 反应速率较快(或反应达到平衡需要时间短) 温度 NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol E1=134kJ/mol
【解析】
I.(1)由表格可知,随着反应时间的延长,A最终物质的量不变,且未消耗完,故该反应为可逆反应;
(2)由表格中数据对比可知,实验2达到平衡所需时间较实验1短很多,故实验2使用了催化剂;
故答案为:2;反应速率较快(或反应达到平衡需要时间短);
(3)实验3的反应温度升高了,相对于实验1速率加快了,故该实验表明,影响化学反应速率的因素还有温度;
II.由图可知,1molNO2和1molCO反应生成1molCO2和1molNO过程放出(368-134)kJ=234kJ能量,故该反应的热化学方程式为:NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol;活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,该反应的活化能为E1=134kJ/mol。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:
![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。
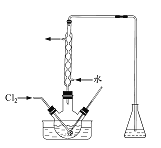
![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。