题目内容
20.氯气在科技、生产中应用广泛.(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O.
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,也可用浓氨水吸收氯气,同时生成一种无污染的气体,该反应的化学方程式是2I-+Cl2═I2+2Cl-或2Fe2++Cl2═2Fe3++2Cl-;3Cl2+8NH3═6NH4Cl+N2或3Cl2+2NH3═6HCl+N2.
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如图:

写出二氧化氯发生器中生成二氧化氯的离子方程式2ClO3-+SO2═2ClO2+SO42-.
(4)FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如图:
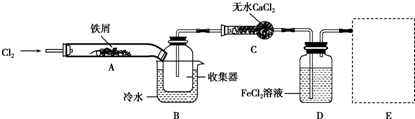
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
①装置D中FeCl2的作用是吸收Cl2,②画出尾气吸收装置E并注明试剂
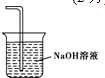 .
.
分析 (1)氯气和氢氧化钙反应生成氯化钙和次氯酸钙;
(2)氯气和浓氨水反应生成氮气和氯化铵;
(3)根据反应流程可知,反应1为氯酸钠在酸性条件下被二氧化硫还原成ClO2,根据元素守恒和电荷守恒写离子方程式;
(4)①亚铁离子具有还原性,能与氯气反应,检验铁离子可以利用硫氰化钾溶液;
②用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸.
解答 解:(1)氯气与熟石灰反应生成氯化钙、次氯酸钙和水,化学反应为2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O,
故答案为:2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O;
(2)氯气具有强氧化性,可与KI溶液、FeCl2溶液发生氧化还原反应,反应的离子方程式为2I-+Cl2═I2+2Cl-,2Fe2++Cl2═2Fe3++2Cl-,氯气和浓氨水反应生成氮气和氯化铵,反应方程式为8NH3+3Cl2=N2+6NH4Cl,
故答案为:2I-+Cl2═I2+2Cl-或2Fe2++Cl2═2Fe3++2Cl-;3Cl2+8NH3═6NH4Cl+N2或3Cl2+2NH3═6 HCl+N2;
(3)根据反应流程可知,反应1为氯酸钠在酸性条件下被二氧化硫还原成ClO2,反应的离子方程式为2ClO3-+SO2═2ClO2+SO42-,
故答案为:2ClO3-+SO2═2ClO2+SO42-;
(4)①亚铁离子具有还原性,所以氯化亚铁的作用是吸收Cl2,故答案为:吸收Cl2;
②用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,图为 ,故答案为:
,故答案为: .
.
点评 本题综合考查氯气的性质和应用,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是( )
| A. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023个 | |
| B. | 含1 mol FeCl3的FeCl3饱和溶液完全反应可以生成1mol Fe(OH)3胶体粒子 | |
| C. | 11.2L二氧化碳气体中所含的分子数为0.5NA | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
5.美国UNC化学教授Thomas J.Meyer等研发了环境友好、完全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物.已知10mL Na2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为( )
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
12.未来新能源的特点是资源丰富,使用时对环境无污染或很少污染,且有些可以再生,下列全部属于新能源的是一组是( )
①天然气 ②煤 ③核能 ④石油 ⑤海洋能 ⑥地热能 ⑦风能 ⑧氢能.
①天然气 ②煤 ③核能 ④石油 ⑤海洋能 ⑥地热能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑤⑥ | D. | 除①②外 |
10.下列说法正确的是( )
| A. | 按系统命名法,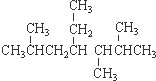 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 肌醇  与葡萄糖 与葡萄糖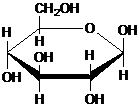 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 总物质的量一定时,乙炔和乙醛以任意比混合,完全燃烧消耗氧气量不变 |
