题目内容
2.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:①HCl ②H2SO4③CH3COOH ④NH4Cl ⑤NaOH.其溶液中由水电离出的c(H+)的大小关系是( )| A. | ①=②>③>④>⑤ | B. | ④>③>①=⑤>② | C. | ③>①>②>④>⑤ | D. | ④>③>①>⑤>② |
分析 酸或碱抑制水电离,含有弱根离子的盐促进水电离,酸的酸性越强,其抑制水电离程度越大,据此分析解答.
解答 解:等浓度的这五种溶液中,氯化氢、硫酸和氢氧化钠都抑制水电离,硫酸中氢离子浓度是盐酸中氢离子浓度的2倍,所以硫酸抑制水电离程度大于盐酸和氢氧化钠,氢氧化钠中氢氧根离子浓度和盐酸中氢离子浓度相等,所以二者抑制水电离程度相等,醋酸中氢离子浓度小于盐酸,所以醋酸抑制水电离程度小于盐酸,氯化铵是强酸弱碱盐,促进水电离,所以由水电离出的C(H+)大小关系正确的是:④>③>①=⑤>②,
故选:B.
点评 本题主要考查的是水的电离以及盐类的水解的应用,本题的难度不大,属于常考题,注意总结.

练习册系列答案
相关题目
12.下列化学实验操作或事故处理方法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| C. | 酒精灯着火时可用水扑灭 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
13.向含有KBr、NaI的混合溶液中通入过量的Cl2充分反应后,将溶液蒸干并进行灼烧,最后所得的固体物质是( )
| A. | NaCl和KCl | B. | KCl和NaBr | C. | NaCl和KI | D. | NaCl、KCl和I2 |
10.某种药物合成中间体结构简式为: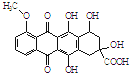 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
17.元素周期表中前7周期的元素数目如下表所示:
(1)第6、7周期比第4、5周期多了14种元素,其原因是第六、七周期在第ⅢB族中出现了镧系、锕系.
(2)周期表中第ⅢB族所含元素最多,第ⅣA族元素形成化合物种类最多.
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为C.
A.18 B.32 C.50 D.64.
| 周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(2)周期表中第ⅢB族所含元素最多,第ⅣA族元素形成化合物种类最多.
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为C.
A.18 B.32 C.50 D.64.
7. 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )| A. | NH3分子内可以形成氢键,故NH3很容易液化 | |
| B. | a电极的电极反应式为:NH3-5e-+5OH-═NO+4H2O | |
| C. | 正极消耗标准状况下空气2.24L时,电池中转移的电子数目为0.4NA | |
| D. | 反应过程中,K+向b极移动.一段时间后,电解质溶液的pH将减小 |
14.下列离子方程式书写正确的是( )
| A. | 向硫化钠中加入少量氯化铁S2-+2 Fe3+═2 Fe2++S↓ | |
| B. | 向Na2FeO4溶液中通入氧气和少量亚硫酸溶液10H++2 FeO42-+SO32-+O2═2Fe3++SO42-+5H2O | |
| C. | 用盐酸酸化的高锰酸钾溶液与过氧化氢反应,证明过氧化氢具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | 少量SO2通入苯酚钠溶液中2C6H5O-+SO2+H2O═C6H5OH+SO32- |
4.常温下,AgCl、AgI的溶度积常数(Ksp)依次为1.8×10-10mol2•L-2、8.3×10-17mol2•L-2.下列有关沉淀溶解平衡的说法正确的是( )
| A. | KSP(AB2)小于KSP(CD),则AB2的溶解度一定小于CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |