题目内容
【题目】为了充分利用铜资源,某工厂利用废旧黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
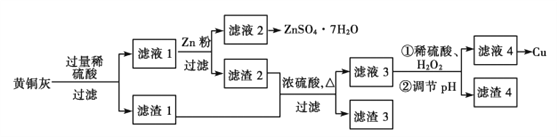
(1)滤渣1的主要成分为__________。稀硫酸溶解黄铜灰过程中,Cu是否参与了反应,如果参与请写出该反应的离子反应方程式,如果没反应请写出理由:_____________________。
(2)滤渣1及滤渣2与浓硫酸反应的步骤中存在缺陷,可将实验改进为先让滤渣与_______反应,产物再溶于稀硫酸,这样改进的优点是_____________________________________。
(3)写出滤液3与H2O2反应的离子反应方程式____________________________________,滤液3反应中需要调节PH的目的是______________________________________________。
(4)25 ℃时,沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如下图所示。
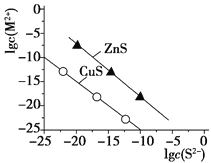
则Ksp(CuS)=_____________________。
【答案】 Cu和SiO2 Cu+2Fe3+=2Fe2++Cu2+ O2 滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是SO2污染环境,同时减少了硫酸的用量(其它合理答案均可得分) 2Fe2++H2O2+2H+=2Fe3++2H2O 调节pH,使Fe3+转化为氢氧化铁沉淀除去 1×10-35
【解析】(1)黄铜灰中不与稀硫酸反应的物质是Cu和二氧化硅,所以加入稀硫酸过滤后的滤渣1的主要成分是单质铜和二氧化硅。黄铜灰中有氧化铁,与稀硫酸反应得到Fe3+,单质铜可以与其反应,方程式为:Cu+2Fe3+=2Fe2++Cu2+。注意:因为氧化铁为少量,所以最后一定剩余单质铜,滤渣1中应该有单质铜。
(2)滤渣2主要含单质铜和铁,滤渣1主要含单质铜和二氧化硅,加入浓硫酸反应,将单质铁和铜转化为盐溶液,滤渣3为二氧化硅。此步反应中的最大问题是,生成二氧化硫这样的污染性气体,所以应该先加入氧气氧化,将金属单质氧化为金属氧化物,再与稀硫酸反应。同时这样的操作可以减少硫酸的用量(因为用浓硫酸时,一部分硫酸转化为二氧化硫,而使用稀硫酸时,所有的硫酸都转化为硫酸盐)。
(3)在滤液3中加入硫酸和过氧化氢的目的是为了将Fe2+氧化为Fe3+,所以方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O。滤液3氧化以后,溶液中主要是Cu2+和Fe3+,调节pH的目的是将Fe3+转化为氢氧化铁沉淀,以将两种金属阳离子分离。
(4)从图中得到:横坐标为-10的时候纵坐标的数值为-25,即c(S2-)=1×10-10mol/L的时候,c(Cu2+)=1×10-25mol/L,所以CuS的Ksp=1×10-35。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】下列各项中的物质,能满足如图中阴影部分关系的
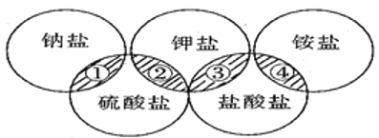
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D