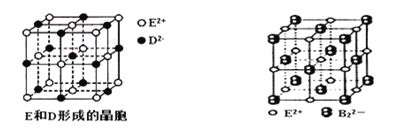
题目内容
【题目】X、Y、Z、W、R五种前四周期元素,原子序数依次增大,其中X原基态时最外层电子数是其内层电子总数的2倍,Z原子基态时s电子数与p电子数相等,Z2-和W+有相同的核外电子排布;R的原子序数为29。回答下列问题:
(1)Y、Z、W三种元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)若M分子是Y2Z的等电子体,M的结构式为______, M分子的中心原子的轨道杂化类型为________, 1molM中含有_____molσ键。
(3)Y的简单氢化物极易溶于Z的简单氢化物中,其主要原因是_____________。
(4)基态R+离子的核外电子排布式是__________,R的高价离子与Y的最常见氢化物形成的配离子的化学式为________________。
(5)Z与W形成的化合物W2Z的晶胞如图。其中Z离子的配位数为________,与一个Z离子距离最近的所有W离子为顶点构成的几何体为________结构。若W2Z的晶胞边长为a pm,则该化合物的密度为_______g·cm-3(列出计算式即可,阿伏伽德罗常数用NA表示)。
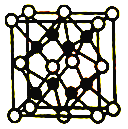
【答案】 Na<O<N O=C=O或S=C=S sp 2 NH3与H2O都是极性分子,且NH3与H2O分子间能形成氢键 [Ar]3d10 [Cu(NH3)4]2+ 8 立方体 ![]()
【解析】X原基态时最外层电子数是其内层电子总数的2倍,推出X为C,Z原子基态时s电子数与p电子数相等,应是1s22s22p4,因此推出Z为O,原子序数依次增大,即Y为N,Z2-和W+有相同的核外电子排布,推出W为Na,R的原子序数为29,则R为Cu,(1)本题考查第一电离能规律,同周期从左向右,第一电离能增大,但IIA>IIIA,VA>VIA,即第一电离能N>O,越容易失电子第一电离能越小,即Na<O,因此大小顺序是Na<O<N;(2)考查等电子体,杂化类型、化学键,Y2Z是N2O,与N2O等电子体的分子式CO2或CS2,其结构式为:O=C=O或S=C=S;CO2或CS2中中心原子为C,有2个σ键,无孤电子对,因此杂化方式sp,成键电子对之间只能形成一个σ键,根据CO2或CS2的结构式,无论1molCO2还是CS2,含有2molσ键;(3)考查分子化合物的溶解性,Y的氢化物是NH3,Z的简单氢化物是H2O,NH3极易溶于水,是因为NH3与H2O形成分子间氢键,且两者属于极性分子,相似相溶;(4)本题考查核外电子排布式,和配合物书写,R+是Cu+,Cu的价电子排布式为3d104s1,因此Cu+的核外电子排布式为:[Ar]3d10 ,R的高价离子与Y的最常见氢化物形成的配离子的化学式为_R的最高价离子是Cu2+,Y的氢化物是NH3,Cu2+提供配位键,NH3中N提供孤电子对,形成配位键,即化学式为[Cu(NH3)4]2+;(5)考查配位数、空间构型、晶胞的计算,W2Z是Na2O,白球位于顶点和面心,个数为8×1/8+6×1/2=4,黑球全部位于晶胞内,个数为8,因此推出白球是O2-,黑球是Na+,根据晶胞的结构,O2-的配位数为8,与O2-距离最近Na+构成几何体为立方体,晶胞的质量为4×62/NAg,晶胞的体积(a×10-10)3cm3,根据密度的定义,密度是. ![]() g/cm3。
g/cm3。

【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:( )

物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64. 7 | ﹣97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
下列说法正确的是( )
A. 分离出甲醇的操作是结晶 B. 间苯三酚与苯酚互为同系物
C. 上述合成反应属于取代反应 D. 洗涤时可以用饱和Na2CO3溶液除氯化氢
【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选项 | A | B | C | D |
物质 | CaCl2 | H2O2 | H2SO4 | NH4Cl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
A. A B. B C. C D. D