题目内容
某工业混合液中可能含有的组分是:乙醚(C4H10O)、乙醇(C2H6O)和水。经分析,液体中各原子数之比为C∶H∶O=16∶42∶5。(1)若混合液中只含有两种组分,则所有可能的组合是___________。
(2)若混合液中含有三种组合,在
解析:(2)由于混合液组成为(CH2)16(H2O)5,相对分子质量314,所以可以认为
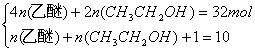
解之n(乙醚)=7 mol,n(CH3CH2OH)=2 mol。
答案:(1)乙醚和水,乙醚和乙醇
(2)2 mol 7 mol

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目