题目内容
某工业混合液中含有的组分仅可能是乙醚(C4H10O)、乙醇(C2H6O)和水。经分析,液体中各原子数之比为N(C):N(H):N(O)=16:42:5。
(1)若混合液只有两种组分,则可能的组合是___________。
(2)若混合液有三种组分,在628 g混合液中含1 mol H2O,此时乙醚和乙醇的物质的量分别是___________、___________。
(1)乙醚和乙醇、乙醚和水 (2)7 mol 2 mol
解析:
混合液中乙醚和乙醇含有的C、H原子比分别为2:5和2:6,混合液中的C、H原子数之比为2:5.25,故一定有乙醚。
若混合物只有两种组分,则可能为乙醚和水或乙醚和乙醇。
若混合物含有三种组分,可按下面的方法推断:
设C4H10O的物质的量为x,C2H6O的物质的量为y。已知水为1 mol,则有
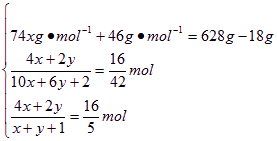
![]()

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目