题目内容
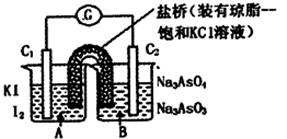
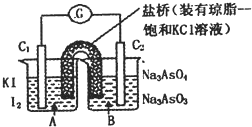
已知反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应、设计如图装置,进行下述操作:
AsO33-+I2+H2O是可逆反应、设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转、试回答:
(1)两次操作过程中指针为什么会发生偏转?
答:___________________.
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:___________________.
(3)(Ⅰ)操作过程中C1棒上发生的反应为________.
(4)(Ⅱ)操作过程中C2棒上发生的反应为________.
答案:
解析:
解析:
(1)这是原电池,指针偏转是由于电子流过电流表![]() ;(4分)
;(4分)
(2)B中加盐酸,AsO43-发生得电子反应;而当加入NaOH后,AsO33-发生失电子反应,为负极;(4分)
(3)2I--2e-=I2;(2分)
(4)AsO33--2e-+H2O=AsO43-+2H+.(2分)

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
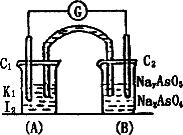
已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。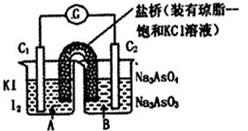
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e - = AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为:2I- - 2e- = I2 |
 已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.
已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作. AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。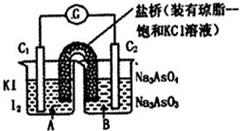
 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。