题目内容
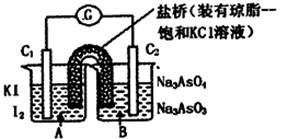
已知反应AsO43-+2I-+2H+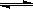 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e - = AsO33-+H2O
D.Ⅱ操作过程中,C1棒上发生的反应为:2I- - 2e- = I2
【答案】
C
【解析】
试题分析:A项:发生正反应,C1为负极,故错;B项:发生逆反应,C2为负极,盐桥中的K+移向A烧杯溶液,故错;D项:Ⅱ操作过程中,C1棒上发生的反应为:I2+2e- =2I-,故错。故选C。
考点:原电池的工作原理 电极反应式的书写
点评:本题考查原电池的工作原理,题目难度不大,注意电解质溶液的酸碱性不同,电极反应不同,此为易错点。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
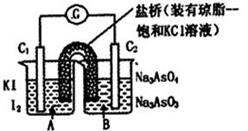
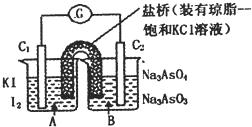
已知反应AsO43-+2I-+2H+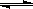 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。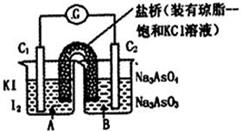
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e - = AsO33-+H2O |
| D.Ⅱ操作过程中,C1棒上发生的反应为:2I- - 2e- = I2 |
 已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作.
已知反应AsO43-+2I一+2H+?AsO43-+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作. AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。