题目内容
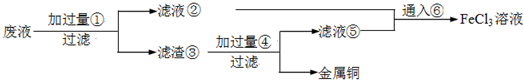
某实验小组用工业上废弃固体(主要成分为Cu2S和Fe2O3混合物)制取铜和FeCl3固体,设计的操作流程如下:
(1)除酒精灯和铁架台或三角架外,①中所需的容器为______,①和⑥中都用到的仪器为______.
(2)固体B加入稀盐酸后,④的操作是______.
(3)试剂x的化学式为______,X与溶液B反应的离子方程式为______.
(4)在实验室中,用36.5%的盐酸,配制1L 3mol?L-1的盐酸,则需量取36.5%的盐酸______mL.
(5)简述溶液C中所含金属阳离子的检验方法______.
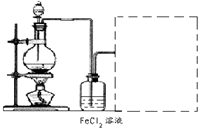
(6)第⑦步操作中,所需装置如图所示:

①按气流方向从左到右的顺序,各装置的连接顺序为______.
②C的作用是______.
【答案】分析:(1)①、固体灼烧用到坩埚;①和⑥中都用到的玻璃棒;
(2)④的操作是过滤、洗涤;
(3)x为氧化剂,可以是双氧水,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸需要氯化氢3mol,根据“36.5%(密度为1.19g?mL-1)的盐酸”求算盐酸的体积;
(5)三价铁离子的检验方法;
(6)①、先制取氯化氢气体,然后用浓硫酸干燥,再通入加热的氯化铁晶体,最后用碱石灰吸收氯化氢;
②、C的作用是吸收HCl和防止空气中的水蒸气进入.
解答:解:(1)①、灼烧固体应该放在坩埚中;①和⑥操作都用到玻璃棒,故答案为:坩埚; 玻璃棒;
(2)固体B加入稀盐酸后,再过滤、洗涤,得到A溶液,故答案为:过滤、洗涤;
(3)试剂X具有氧化性,将亚铁离子氧化成三价铁离子,可以选用双氧水,反应方程式为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸,需要3mol的氯化氢,设需要36.5%(密度为1.19g?mL-1)的盐酸的体积为VmL,则有:3mol×36.5g/mol=VmL×1.19g?mL-1×36.5%,解得V=252.1mL;
故答案为:252.1;
(5)溶液C中所含金属阳离子是Fe3+,检验方法是:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
故答案为:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
(6)①、加热氯化铁晶体制取氯化铁固体,需要在氯化氢气体中进行,装置连接应该是先制取、干燥氯化氢,然后通入盛有氯化铁晶体的大试管,最后吸收氯化氢,连接顺序是:DABC,故答案为:DABC;
②、C是用来吸收氯化氢和防止水蒸气加入试管的,故答案为:吸收HCl和防止空气中的水蒸气进入.
点评:本题考查氯化铁固体的制取,注重了基础知识考查,注意分析题中信息,合理解答,本题难度中等.
(2)④的操作是过滤、洗涤;
(3)x为氧化剂,可以是双氧水,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸需要氯化氢3mol,根据“36.5%(密度为1.19g?mL-1)的盐酸”求算盐酸的体积;
(5)三价铁离子的检验方法;
(6)①、先制取氯化氢气体,然后用浓硫酸干燥,再通入加热的氯化铁晶体,最后用碱石灰吸收氯化氢;
②、C的作用是吸收HCl和防止空气中的水蒸气进入.
解答:解:(1)①、灼烧固体应该放在坩埚中;①和⑥操作都用到玻璃棒,故答案为:坩埚; 玻璃棒;
(2)固体B加入稀盐酸后,再过滤、洗涤,得到A溶液,故答案为:过滤、洗涤;
(3)试剂X具有氧化性,将亚铁离子氧化成三价铁离子,可以选用双氧水,反应方程式为:2Fe2++H2O2 +2H+=2Fe3++2H2O;
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(4)配制1L 3mol?L-1的盐酸,需要3mol的氯化氢,设需要36.5%(密度为1.19g?mL-1)的盐酸的体积为VmL,则有:3mol×36.5g/mol=VmL×1.19g?mL-1×36.5%,解得V=252.1mL;
故答案为:252.1;
(5)溶液C中所含金属阳离子是Fe3+,检验方法是:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
故答案为:取少量C于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,则含有Fe3+;
(6)①、加热氯化铁晶体制取氯化铁固体,需要在氯化氢气体中进行,装置连接应该是先制取、干燥氯化氢,然后通入盛有氯化铁晶体的大试管,最后吸收氯化氢,连接顺序是:DABC,故答案为:DABC;
②、C是用来吸收氯化氢和防止水蒸气加入试管的,故答案为:吸收HCl和防止空气中的水蒸气进入.
点评:本题考查氯化铁固体的制取,注重了基础知识考查,注意分析题中信息,合理解答,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按如图所示方法分离和提取金属单质:
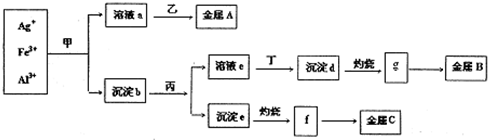
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备.对该实验分析正确的是( )

已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备.对该实验分析正确的是( )
| A、金属A、B、C分别为Ag、Fe、Al | B、g、f都为氧化物,工业上均采用电解g与f获得对应金属单质 | C、沉淀b为混合物,主要成分为沉淀d和沉淀e | D、甲是氢氧化钠,丁为稀硫酸 |
 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀