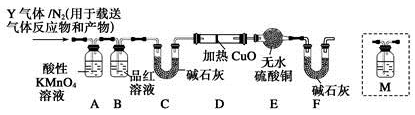
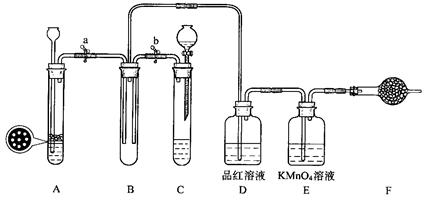
题目内容
已知乙烯能使酸性高锰酸钾溶液褪色,下列褪色原理与其一致的是( )
| A.SO2使品红溶液褪色 | B.乙烯使溴水褪色 |
| C.SO2使溴水褪色 | D.甲烷使氯气褪色 |
C
试题分析:乙烯能使酸性高锰酸钾溶液褪色是被氧化,发生的是氧化还原反应。A.SO2使品红溶液褪色发生的是结合漂白,错误;B.乙烯使溴水褪色发生的是加成反应,错误;C.SO2使溴水褪色发生的是氧化还原反应,正确;D.甲烷使氯气褪色发生的是取代反应,错误。

练习册系列答案
相关题目