题目内容
(13分)硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
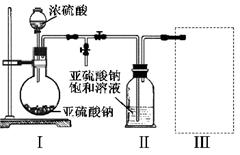
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。

①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、、Na2SO4、NaHSO4 |
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。

①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。
(13分)
(1)Na2SO3。(2分)
(2)①2SO2+O2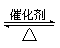 2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分)
2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分)
②使SO3凝结成固体与SO2分离;(2分,只要合理即给分)
5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+(3分,没配平扣1分)
③SO2+NaOH=NaHSO3(4分)
(1)Na2SO3。(2分)
(2)①2SO2+O2
 2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分)
2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分) ②使SO3凝结成固体与SO2分离;(2分,只要合理即给分)
5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+(3分,没配平扣1分)
③SO2+NaOH=NaHSO3(4分)
试题分析:(1)根据第3组的化学式判断,M是Na2SO3;
(2)①装置I发生的二氧化硫的催化氧化反应,化学方程式为2SO2+O2
 2SO3
2SO3②三氧化硫的熔点较低,二氧化硫的沸点较低,所以装置Ⅱ的作用是使SO3凝结成固体与SO2分离;二氧化硫与酸性高锰酸钾溶液发生氧化还原反应,生成硫酸根离子和Mn2+、水,离子方程式为5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+;
③30mL 2.5mol/LNaOH溶液中氢氧化钠的物质的量是0.075mol,反应后增重4.8g,即二氧化硫的质量是4.8g,物质的量是0.075mol,二者的物质的量之比是1:1,所以生成的产物是亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3。

练习册系列答案
相关题目