题目内容
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
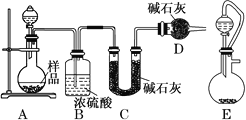
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
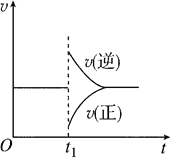
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

【答案】使固体样品受热均匀,避免局部温度过高,造成样品外溅![]() ×100%避免空气中的水蒸气和二氧化碳进入C装置中,造成实验误差C反应产生的二氧化碳残留在A、B装置内,不能被完全吸收否24%
×100%避免空气中的水蒸气和二氧化碳进入C装置中,造成实验误差C反应产生的二氧化碳残留在A、B装置内,不能被完全吸收否24%
【解析】
试题小苏打久置会发生反应:2NaHCO3![]() Na2CO3+CO2↑+H2O,该样品成分为NaHCO3、Na2CO3,测定样品中纯碱的质量分数方法有:测定二氧化碳的质量、测定碳酸钠的质量、测定碳酸氢钠的质量.
Na2CO3+CO2↑+H2O,该样品成分为NaHCO3、Na2CO3,测定样品中纯碱的质量分数方法有:测定二氧化碳的质量、测定碳酸钠的质量、测定碳酸氢钠的质量.
(1)①使用玻璃棒搅拌,使固体受热均匀,避免局部温度过高,造成固体外溅,
故答案为:使固体受热均匀,避免局部温度过高,造成固体外溅;
②设样品中碳酸氢钠的质量为x,则:
2NaHCO3![]() Na2CO3+CO2↑+H2O 质量减少
Na2CO3+CO2↑+H2O 质量减少
168 62
x (m-a)g
则x=![]() =
=![]() g,故m(Na2CO3)=[m-
g,故m(Na2CO3)=[m-![]() ]g,
]g,
则样品中Na2CO3的质量分数为{[m-![]() ]g÷mg}×100%=
]g÷mg}×100%=![]() ×100%。
×100%。
故答案为:![]() ×100%;
×100%;
(2)①利用C中碱石灰增重测定反应生成二氧化碳的质量,进而计算样品中碳酸钠的质量分数,由于碱石灰可以吸收空气中的二氧化碳与水蒸气,故D装置的作用是吸收空气中的二氧化碳与水蒸气,避免空气中的二氧化碳与水蒸气加入C中,防止测定误差。故答案为:避免空气中的二氧化碳与水蒸气加入C中,造成实验误差;
②C装置反应前后质量之差为反应生成二氧化碳的质量,根据样品总质量、二氧化碳的质量可以计算混合物中碳酸钠的质量,还需分别称量C装置反应前、后的质量。故答案为:C;
③该实验装置有一个明显的缺陷是反应产生的二氧化碳残留在A、B装置内,不能完全被吸收,使C中吸收二氧化碳质量减小,造成较大的误差。故答案为:反应产生的二氧化碳残留在A、B装置内,不能完全被吸收;
④有同学认为,用E装置替代A装置能提高实验准确度,这种说法不正确。因为,E装置用恒压分液漏斗,部分二氧化碳为残留在分液漏斗上部,使C中吸收二氧化碳质量减小,造成较大的误差。故答案为:否;
(3)由图可知,开始发生反应:Na2CO3+HCl=NaHCO3,产生二氧化碳的反应为:HCl+NaHCO3![]() NaCl+CO2↑+H2O,横坐标每个刻度为50mL,令每个刻度为1molHCl,由方程式可知,样品中n(Na2CO3)=1mol,碳酸钠反应生碳酸氢钠为1mol,故原样品中碳酸氢钠的物质的量为5mol-1mol=4mol,则原混合物中碳酸钠的质量分数为
NaCl+CO2↑+H2O,横坐标每个刻度为50mL,令每个刻度为1molHCl,由方程式可知,样品中n(Na2CO3)=1mol,碳酸钠反应生碳酸氢钠为1mol,故原样品中碳酸氢钠的物质的量为5mol-1mol=4mol,则原混合物中碳酸钠的质量分数为![]() ×100%=24%。故答案为:24%.
×100%=24%。故答案为:24%.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)