题目内容
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
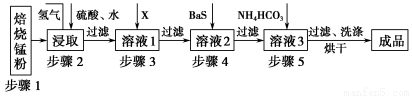
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
(1)四 ⅦB
(2)Zn+H2SO4=ZnSO4+H2↑
(3)①H2O2 ②在酸性条件下加入双氧水,将Fe2+氧化成Fe3+、2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH至3.7~8.6,使Fe3+沉淀完全,Fe3++3H2O??Fe(OH)3+3H+ ③以BaS为沉淀剂,使Pb2+、Cd2+、Hg+等金属离子,生成更难溶的硫化物而除去
(4)MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑
【解析】(2)废电池回收硫酸锌和碳酸锰,故另一个工艺是制取硫酸锌,锌皮与稀硫酸反应生成氢气:Zn+H2SO4=ZnSO4+H2↑
(3)①具有强氧化性的“绿色”氧化剂,显然是H2O2,它的加入也不会引入新的杂质。②由题给的三种离子沉淀pH可知,为除去Fe2+、Fe3+,应将Fe2+先氧化为Fe3+,然后调节溶液的pH在3.7~8.6之间,以便除净Fe3+而不损失Mn2+。③难溶电解质有生成更难溶电解质的趋势,故利用沉淀的转化实现了除去Pb2+、Cd2+、Hg+。
(4)根据气体是无色无味,可知该气体是CO2,故该反应的化学方程式为MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+CO2↑+H2O。

通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
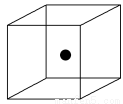
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
Mg(OH)2 | 9.6 | 11.1 |
Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
实验操作 | 预期现象和结论 |
步骤1: |
|
步骤2: |
|
步骤3: |
|
…… |
|