题目内容
(1) 25℃时,部分弱酸的电离平衡常数如下表:
①HCOONa溶液呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)。
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是 。
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”) 。
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

①M、N点对应的温度分别是T1、T2,则T1 T2(填“>”、“=”或“<”)。
②T2时,水的离子积常数Kw= ,pH=9的NaOH溶液中,由水电离产生的c(H+)= mol/L。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(用离子方程式表示)。
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是 。
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”) 。
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

①M、N点对应的温度分别是T1、T2,则T1 T2(填“>”、“=”或“<”)。
②T2时,水的离子积常数Kw= ,pH=9的NaOH溶液中,由水电离产生的c(H+)= mol/L。
(1)①碱 (2分) HCOO-+H2O HCOOH+OH- (2分)
HCOOH+OH- (2分)
②盐酸 (2分) 因为在稀释过程中HCOOH继续电离产生H+,使得溶液中c(H+)较盐酸中的c(H+)大,误差较小(若前一问填HCOOH,此问无分。)(2分)
③CN-+CO2+H2O=HCN+HCO- 3 (2分)
(2)①< (2分) ②1×10-12 (2分) 1×10-9(2分)
 HCOOH+OH- (2分)
HCOOH+OH- (2分) ②盐酸 (2分) 因为在稀释过程中HCOOH继续电离产生H+,使得溶液中c(H+)较盐酸中的c(H+)大,误差较小(若前一问填HCOOH,此问无分。)(2分)
③CN-+CO2+H2O=HCN+HCO- 3 (2分)
(2)①< (2分) ②1×10-12 (2分) 1×10-9(2分)
试题分析:①HCOONa是强碱弱酸盐溶液水解呈碱性,其原因是甲酸根离子发生了水解, HCOO-+H2O
 HCOOH+OH-。②pH试纸不应该润湿,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是盐酸,原因是因为在稀释过程中HCOOH继续电离产生H+,使得溶液中c(H+)较盐酸中的c(H+)大,误差较小。1)由图可知,N点x=-8时,y=-4,M点:x=-12时,y=-4,在不同温度下,前者的Kw大于后者,而水的电离是个吸热反应,温度越高Kw越大,故T1小于T2。②T2时,水的离子积常数Kw=1×10-12,pH=9的NaOH溶液中, 由于碱抑制了水的电离,此时溶液中的氢离子全是水电离出的,故由水电离产生的c(H+)=1×10-9mol/L。
HCOOH+OH-。②pH试纸不应该润湿,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是盐酸,原因是因为在稀释过程中HCOOH继续电离产生H+,使得溶液中c(H+)较盐酸中的c(H+)大,误差较小。1)由图可知,N点x=-8时,y=-4,M点:x=-12时,y=-4,在不同温度下,前者的Kw大于后者,而水的电离是个吸热反应,温度越高Kw越大,故T1小于T2。②T2时,水的离子积常数Kw=1×10-12,pH=9的NaOH溶液中, 由于碱抑制了水的电离,此时溶液中的氢离子全是水电离出的,故由水电离产生的c(H+)=1×10-9mol/L。
练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
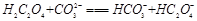
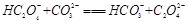
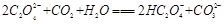
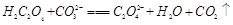
 CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是 CH3COO—+H3O+ K1=1.75×10-5
CH3COO—+H3O+ K1=1.75×10-5