题目内容
实验室中要测定部分变质的过氧化钠的纯度,可用如图装置实现。
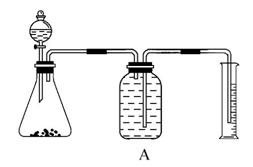
(1)锥形瓶中应放药品________,分液漏斗中放__________,锥形瓶中发生的化学方程式为_________________________________________。
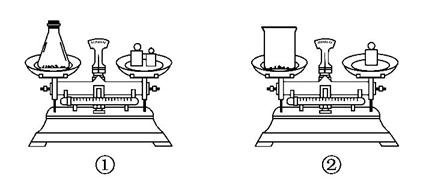
(2)如图用托盘天平称取样品,应选用如图中的__________(填“①”或“②”)。不选用另一装置的原因是___________________________________。
(3)若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为________。
【解析】(1)该装置类型为固体与液体反应,所以锥形瓶中应盛Na2O2,分液漏斗中装水。
(2)由于Na2O2易吸收空气中的CO2和H2O,所以不能暴露在空气中称量,故应选①而不选用②。
(3)产生O2的物质的量为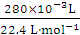 =0.012 5 mol,
=0.012 5 mol,
2Na2O2+2H2O====4NaOH+O2↑
2×78 g 1 mol
m(Na2O2) 0.012 5 mol
m(Na2O2)=1.95 g
 样品中Na2O2的纯度为
样品中Na2O2的纯度为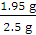 ×100%=78%。
×100%=78%。
答案:(1)Na2O2 H2O
2Na2O2+2H2O====4NaOH+O2↑
(2)① Na2O2易吸收空气中的CO2和H2O
(3)78%

练习册系列答案
相关题目