题目内容
体积均为100ml,物质的量浓度都为3mol/l的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为3:4,则铝的质量为
| A.2.7g | B.3.6g | C.4.8g | D.7.2g |
D
铝与酸碱反应的离子方程式为:
①2Al+6H+=2Al3++3H2↑ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
现在提供的氢离子为0.6mol、OH—为0.3mol,当铝均不足时,生成氢气的体积比为3:3,而当铝均过量时,生成氢气的体积比为3:4.5,而题目中所生成氢气的体积比为3:4,可知,铝相对与碱不足,相对于酸过量:
则由①反应可得:铝与酸产生的氢气为:0.3mol
则由②反应可得:与碱反应产生的氢气为0.4mol,进而可得出铝的质量为:0.4×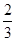 ×27=7.2g
×27=7.2g
故答案为D
①2Al+6H+=2Al3++3H2↑ ② 2Al+2OH-+2H2O=2AlO2-+3H2↑
现在提供的氢离子为0.6mol、OH—为0.3mol,当铝均不足时,生成氢气的体积比为3:3,而当铝均过量时,生成氢气的体积比为3:4.5,而题目中所生成氢气的体积比为3:4,可知,铝相对与碱不足,相对于酸过量:
则由①反应可得:铝与酸产生的氢气为:0.3mol
则由②反应可得:与碱反应产生的氢气为0.4mol,进而可得出铝的质量为:0.4×
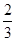 ×27=7.2g
×27=7.2g故答案为D

练习册系列答案
相关题目
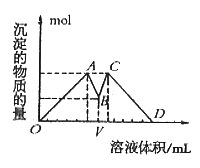
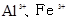 完全反应并生成沉淀最多,则所加入NaOH溶液的体积是
完全反应并生成沉淀最多,则所加入NaOH溶液的体积是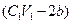 mol
mol