题目内容
20. Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.Ⅱ.容器乙起始投入3molN2、bmolH2,维持恒温、恒压到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同、相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)=0.024mol•L-1•s-1,达平衡时N2的转化率=20%.
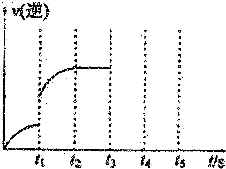
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t1时改变了某种条件,改变的条件可能是升高了温度、增大了氨气的浓度.(填写2项)
(3)下列哪些情况表明容器乙已达平衡状态ADE.(填字母)
A.容器乙的气体密度不再交化
B.反应的平衡常数不再变化
C.氮气与氨气的浓度相等
D.断裂lmolN≡N键同时断裂6molN一H键
E.容器乙中气体的平均相对分子质量不随时间而变化
(4)b=4.5 mol.
分析 (1)列出化学三段式结合题中数据进行计算,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 2 3 0
转化量(mol)0.4 1.2 0.8
平衡量(mol)1.6 1.8 0.8
反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%;
(2)依据图示中t1时的逆反应速率变化及影响化学反应速率的因素判断改变的条件,t1时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率增大,平衡逆向移动,依据好像平衡移动原理选择判断需要改变的条件;
(3)反应达到平衡状态时,正逆反应速率相等,各组分的浓度不变,以及衍生的各种物理量关系进行判断;
(4)平衡时容器甲与容器乙中各物质的体积分数相等,甲中达到平衡时,氨气的体积分数为:$\frac{0.8mol}{1.6mol+1.8mol+0.8mol}$=$\frac{4}{21}$,
容器乙中 N2(g)+3H2(g)?2NH3(g)
起始量(mol) 3 b 0
转化量(mol)0.6 1.8 1.2
平衡量(mol)2.4 b-1.8 1.2
平衡时容器甲与容器乙中各物质的体积分数相等进行计算.
解答 解:(1)N2(g)+3H2(g)?2NH3(g)
起始量(mol) 2 3 0
转化量(mol)0.4 1.2 0.8
平衡量(mol)1.6 1.8 0.8
v(H2)=$\frac{\frac{1.2mol}{5L}}{10s}$=0.024mol•L-1•s-1,
平衡时,氮气的转化率=$\frac{0.4mol}{2mol}$×100%=20%,
故答案为:0.024mol•L-1•s-1;20%;
(2)t1时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率增大,平衡逆向移动,则可能是t1时增大了氨的浓度或升高了温度,
故答案为:升高了温度;增大了氨的浓度;
(3)判断达到平衡的标准是“变化量不变”,
A、恒温、恒压达到平衡下,容器乙中的气体密度不再变化,说明容器体积不再变化,可以说明反应达到平衡状态,故A正确;
B、平衡常数只与温度有关,温度不变时,K总是不变的,所以平衡常数不能作为判断化学平衡状态的依据,故B错误;
C、氮气与氨气的浓度相等和起始量、变换量有关,不能说明反应达到平衡状态,故C错误;
D、断裂1molN≡N键同时断裂6molN-H键,即消耗1mol N2的同时消耗2mol NH3,说明正逆反应速率相等,说明反应达到平衡状态,故D正确;
E、容器乙中气体的平均相对分子质量不随时间而变化,说明体系中各物质的体积分数不变,反应达到平衡状态,故E正确;
故选:ADE;
(4)平衡时容器甲与容器乙中各物质的体积分数相等,甲中达到平衡时,氨气的体积分数为:$\frac{0.8mol}{1.6mol+1.8mol+0.8mol}$=$\frac{4}{21}$,
容器乙中 N2(g)+3H2(g)?2NH3(g)
起始量(mol) 3 b 0
转化量(mol)0.6 1.8 1.2
平衡量(mol)2.4 b-1.8 1.2
氨气的体积分数为:$\frac{1.2}{2.4+b-1.8+1.2}$=$\frac{4}{21}$,
解得:b=4.5,
故答案为:4.5.
点评 本题考查了化学平衡状态的判断、化学反应速率的计算等知识,题目难度中等,要求学生掌握化学平衡状态的判断方法、化学反应速率的计算方法.

| A. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 将一定量的Na2O2和NaHCO3的混合物放在一密闭容器中充分加热后,所得固体中一定含有Na2CO3 | |
| C. | 硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物 | |
| D. | 将足量的稀盐酸加到Mg、AlCl3、NaAlO2组成的混合物中,只能发生一种反应 |

| A. | 原子 | B. | 分子 | C. | 单质 | D. | 元素 |
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.