题目内容
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.Y与Z的最高正价之和等于9 |
| B.Y的气态氢化物比W的稳定 |
| C.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.XY2与ZY2中的化学键类型相同 |
B
解析试题分析:W的单质是空气中体积分数最大的气体,则W是氮气。Z最外层电子数等于最内层电子数,则Z是镁。X、Y、Z的简单离子的电子层结构相同,则X为氧,Y是氟,W与Y最外层电子数之和为X的最外层电子数的2倍,则再次确定X是氧。A项错误;B项中由于氟元素的非金属性强于氮,故错误;C项中原子半径W是最小的,错误;D项中OF2和MgCl2中前者是分子晶体,后者是离子晶体,故错误;
考点:考查运用元素周期律相关知识推断物质。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
元素的性质呈周期性变化的根本原因是 ( )
| A.元素原子量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素的金属性和非金属性呈周期性变化 |
| D.元素原子的核外电子排布呈周期变化 |
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是ⅢA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性
D.若元素Y处于第三周期,它可与冷水剧烈反应
下列叙述中正确的是
| A.两种微粒,若核外电子排布完全相同,其化学性质也一定相同 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.两种原子若核外电子排布相同,则一定属于同种元素 |
| D.存在两种质子数和电子数均相同的阳离子和阴离子 |
元素电负性随原子序数的递增而增强的是
| A.Na K Rb | B.N P As | C.O S Cl | D.Si P Cl |
下列关于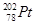 的说法正确的是
的说法正确的是
A.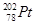 和 和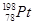 的质子数相同,互称为同位素 的质子数相同,互称为同位素 |
B.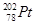 和 和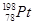 的中子数相同,互称为同位素 的中子数相同,互称为同位素 |
C.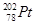 和 和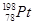 的核外电子数相同,是同一种核素 的核外电子数相同,是同一种核素 |
D.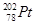 和 和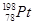 的质量数不同,不能互称为同位素 的质量数不同,不能互称为同位素 |
下列各组顺序的排列错误的是
| A.金属性:Na<Mg<Al | B.热稳定性:HCl>H2S>PH3 |
| C.酸性强弱:H4SiO4<H2CO3<HNO3 | D.熔点:金刚石>食盐>干冰 |
下列判断错误的是
A.沸点: |
B.熔点: |
C.酸性: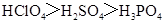 |
D.碱性: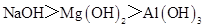 |
 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的