题目内容
【题目】(1)在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
①该盐酸的物质的量浓度是________。
②8.7gMnO2与100mL该盐酸反应,求生成的气体在标准状况下的体积________升。
③向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是________。
(2)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________L,NO2的体积为________L。(结果保留一位小数)
②待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol/L。
③欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
【答案】 12mol/L 2.24L 1mol 5.8 5.4 (aV·10-3+0.5)/0.14 57.8
【解析】(1)①氯化氢的物质的量是537.6L÷22.4L/mol=24mol,因此该盐酸的物质的量浓度是24mol÷2L=12mol/L;②8.7gMnO2的物质的量是8.7g÷87g/mol=0.1mol,100mL该盐酸的物质的量是12mol/L×0.1L=1.2mol,根据方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知浓盐酸过量,生成氯气是0.1mol,在标准状况下的体积是2.24L。③向反应后的溶液中加入足量的AgNO3溶液,根据氯离子守恒可知生成氯化银沉淀的物质的量是1.2mol-0.1mol×2=1.0mol。(2)①铜的物质的量是32.64g÷64g/mol=0.51mol,失去电子的物质的量是0.51mol×2=1.02mol。混合气体的物质的量是11.2L÷22.4L/mol=0.5mol,设NO是xmol、NO2是ymol,则x+y=0.5、3x+y=1.02,解得x=0.26、y=0.24,所以NO的体积为0.26mol×22.4L/mol=5.8L,NO2的体积为0.24mol×22.4L/mol=5.4L。②待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中的溶质是硝酸钠,根据钠离子守恒可知硝酸钠的物质的量是0.001aVmol,根据氮原子守恒可知原硝酸的物质的量是0.001aVmol+0.5mol,则硝酸溶液的浓度为(0.001aVmol+0.5mol)/0.14L=(aV+500)/140 mol/L。③使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,这说明NO和NO2失去电子,因此根据电子得失守恒可知双氧水得到的电子就是铜失去的电子,所以需要双氧水的物质的量是1.02mol÷2=0.51mol,质量是0.51mol×34g/mol=17.34g,则至少需要30%的双氧水的质量是17.34g÷0.3=57.8g。
MnCl2+Cl2↑+2H2O可知浓盐酸过量,生成氯气是0.1mol,在标准状况下的体积是2.24L。③向反应后的溶液中加入足量的AgNO3溶液,根据氯离子守恒可知生成氯化银沉淀的物质的量是1.2mol-0.1mol×2=1.0mol。(2)①铜的物质的量是32.64g÷64g/mol=0.51mol,失去电子的物质的量是0.51mol×2=1.02mol。混合气体的物质的量是11.2L÷22.4L/mol=0.5mol,设NO是xmol、NO2是ymol,则x+y=0.5、3x+y=1.02,解得x=0.26、y=0.24,所以NO的体积为0.26mol×22.4L/mol=5.8L,NO2的体积为0.24mol×22.4L/mol=5.4L。②待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中的溶质是硝酸钠,根据钠离子守恒可知硝酸钠的物质的量是0.001aVmol,根据氮原子守恒可知原硝酸的物质的量是0.001aVmol+0.5mol,则硝酸溶液的浓度为(0.001aVmol+0.5mol)/0.14L=(aV+500)/140 mol/L。③使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,这说明NO和NO2失去电子,因此根据电子得失守恒可知双氧水得到的电子就是铜失去的电子,所以需要双氧水的物质的量是1.02mol÷2=0.51mol,质量是0.51mol×34g/mol=17.34g,则至少需要30%的双氧水的质量是17.34g÷0.3=57.8g。

【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
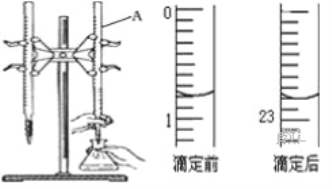
(1)仪器A的名称是__________________;
(2)盐酸滴定管中滴定后读数为_____________mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________;
(6)滴定操作时,如果上述B步骤省略,对测定结果的影响是_____(填“无影响”、“偏高”或“偏低”)。