题目内容
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是
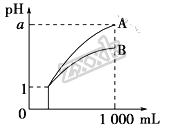
①若a<4,则A、B都是弱酸 且电离平衡常数K(A)<K(B)
②稀释后,B酸溶液的酸性比A酸溶液强
③若a=4,则A是强酸,B是弱酸
④稀释前A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
【答案】B
【解析】pH=1的两种酸溶液各1mL加水稀释到1000mL,体积变为原来的1000倍,若为强酸则稀释后的pH=4。①若a![]() 4,则A、B都是弱酸,由于pH的改变值:A
4,则A、B都是弱酸,由于pH的改变值:A![]() B,则酸性:A
B,则酸性:A![]() B,电离平衡常数:K(A)
B,电离平衡常数:K(A)![]() K(B),错误;②稀释后,B酸溶液的pH小于A酸溶液的pH,B酸溶液的酸性比A酸溶液强,正确;③若a=4,则A是强酸,B的pH改变值小于3,B是弱酸,正确;④pH的改变值:A
K(B),错误;②稀释后,B酸溶液的pH小于A酸溶液的pH,B酸溶液的酸性比A酸溶液强,正确;③若a=4,则A是强酸,B的pH改变值小于3,B是弱酸,正确;④pH的改变值:A![]() B,则酸性:A
B,则酸性:A![]() B,稀释前等pH的酸A与酸B物质的量浓度:A
B,稀释前等pH的酸A与酸B物质的量浓度:A![]() B,错误;正确的为②③,答案选B。
B,错误;正确的为②③,答案选B。

练习册系列答案
相关题目
