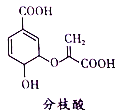
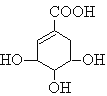
��Ŀ����
����Ŀ���ҹ������緢�ֲ�ʹ��п�Ĺ��ң����칤���������¯��ʯ��ZnCO3����ľ̿ұ��п���ִ���ҵ��������п�̻ң���Ҫ�ɷ�ΪZnO������Pb��CuO��As2O3����ȡ�ߴ�п�Ĺ���������ͼ��ʾ��
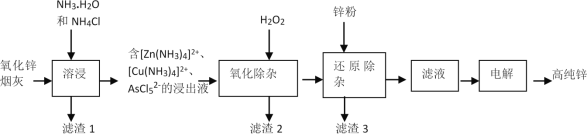
��ش��������⣺
��1�����칤�������п�ķ�����������ľ̿��___�ԡ�
��2�����ܽ���ʱ������п���뷴Ӧ��������ӷ���ʽ��____��
��3��п���������¶ȵĹ�ϵ��ͼ��ʾ������30��ʱп��������ߵ�ԭ��Ϊ___��

��4����������������Ŀ���ǽ�AsCl52-ת��ΪAs2O5���壬�پ������۳���ȥ���÷�Ӧ�����ӷ���ʽ��____��
��5��������3������Ҫ�ɷ�Ϊ___��
���𰸡���ԭ ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O��ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2 ����30��ʱ���ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½� 2AsCl52-+2H2O2+H2O=As2O5(����)+10Cl-+6H+ Cu
��������
��1��̼��п��̼�ڸ����·�Ӧ����п��һ����̼��̼����Ϊ��ԭ�ԣ�
�ʴ�Ϊ����ԭ��
��2����������ʱ��ZnO�����Ȼ�狀Ͱ�ˮ�Ļ����Һ������������Zn��NH3��42+��������Ӧ�����ӷ���ʽΪ��ZnO+2NH3+2NH4+=[Zn��NH3��4]2++H2O��ZnO+2NH3H2O+2NH4+=[Zn��NH3��4]2++3H2O��
�ʴ�Ϊ��ZnO+2NH3+2NH4+=[Zn��NH3��4]2++H2O��ZnO+2NH3H2O+2NH4+=[Zn��NH3��4]2++3H2O��
��3�������¶���п�����ʵ�ͼ��֪��30������ʱ��������ߣ������30�棬�ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½���
�ʴ�Ϊ������30�棬�ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½���
��4���������������У�AsCl52-ת��ΪAs2O5���������۳���ȥ����Ӧ�����ӷ���ʽΪ��2AsCl52-+2H2O2+6NH3H2O=As2O5�����壩+10Cl-+6NH4++5H2O��
�ʴ�Ϊ��2AsCl52-+2H2O2+6NH3H2O=As2O5�����壩+10Cl-+6NH4++5H2O��
��5����ԭ���ӹ����У���Һ�е�Cu2+�������Zn���û���Cu������3����Cu��
�ʴ�Ϊ��Cu��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��������Ϊ����һ����������Ϊ������Ԫ�����������γɵ���������dz��ḻ������������������;�㷺��
��1����̬Sԭ����___��������ͬ�ĵ��ӣ���۵����Ų�ͼΪ___��
��2�������γ�S2O![]() ��SO
��SO![]() �ȶ��ֺ�����������Ʋ�S2O
�ȶ��ֺ�����������Ʋ�S2O![]() �Ŀռ乹��Ϊ___��SO
�Ŀռ乹��Ϊ___��SO![]() ������ԭ���ӻ���ʽΪ___��
������ԭ���ӻ���ʽΪ___��
��3��SCN-��Fe3+�ܷ�����ɫ��Ӧ���÷�Ӧ����������Fe3+�Ĵ��ڡ�
����Ԫ��λ��Ԫ�����ڱ���___����
��SCN-������Ԫ�صĵ縺���ɴ�С��˳��Ϊ___����Ԫ�ط��ű�ʾ����д����SCN-��Ϊ�ȵ�����ķ��ӵķ���ʽ___����дһ�֣���
��Fe(SCN)3�в����ڵĻ�ѧ����___�����ţ���
A.���Ӽ� B.���Լ� C.�Ǽ��Լ� D.��λ�� E.���� F.����
��4������±�������۵����±���ʾ��
±���� | FeF3 | FeCl3 |
�۵�/�� | 1100 | 306 |
���ͱ�������֮���۵�����ԭ��___��
��5��ij�����������������ᄃ����ͼ��ʾ������A��B���ַ�����ɡ�

�ٸ���������Fe2+��Fe3+��O2-���������������Ϊ___��
�ڼ�֪�þ�����ܶ�Ϊdg��cm-3�������ӵ�������ֵΪNA��������aΪ___ nm���ú�d��NA�Ĵ���ʽ��ʾ����
����Ŀ�������ᡢ���ᡢ��������ᶼ��ǿ�ᣬ��������ˮ��Һ�в��������ij�¶������������ڱ������еĵ��볣�����±�����ӱ������ж�����˵������ȷ���ǣ� ��
�� | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6��10��5 | 6.3��10��9 | 1.6��10��9 | 4.2��10��10 |
A.�ڱ��������������ᶼû����ȫ����
B.�ڱ������и�������������������ǿ����
C.�ڱ�����������ĵ��뷽��ʽΪH2SO4=2H����SO42-
D.ˮ�������������ǿ��û����������������������������������ǿ��