题目内容
17.用CuSO4溶液电解精炼粗铜(含有Fe、Zn、Ag、Pt等杂质),下列叙述正确的是( )| A. | 纯铜作阳极 | |
| B. | 阴极发生氧化反应 | |
| C. | 电解后后c(Cu2+)保持不变 | |
| D. | 电解槽底部会生成含有Ag、Pt的阳极泥 |
分析 A、铜的电解精炼是粗铜做阳极,精铜做阴极,铜盐溶液做电解质;
B、阴极是溶液中铜离子得到电子生成铜;
C、根据两极上的电极反应来判断铜离子浓度的变化;
D、阳极上的锌铁会失电子生成离子,阳极泥是银等沉积.
解答 解:A、电解精炼铜时,粗铜应作阳极,精铜作阴极,故A错误;
B、阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应,阴极上发生的反应是Cu2++2e-=Cu,故B错误;
C、在阳极上金属锌、铁、镍先于金属铜失电子,在阴极上自始至终都是铜离子得电子,即铜离子减少时,还没有铜离子进入电解质溶液,所以电解后后c(Cu2+)减小,故C错误;
D、金属的活动性顺序为Zn>Fe>Cu>Ag>Pt,Fe、Zn失电子生成离子,Ag、Pt不会放电,以单质形式沉积下来,故D正确;
故选D.
点评 本题主要考查电解原理及其应用.电化学原理是高中化学的核心考点,本题利用电解法进行粗铜提纯时粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应;题目难度中等.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
5.钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O═CO2+Pd↓+2HC1.下列说法正确的是( )
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 生成22.4L CO2时,转移的电子为2 mo1 | |
| D. | 题述反应中CO2为还原产物 |
12.某年在长江流域发生大洪水,在受灾地区为了保证饮用水的质量,减少疾病的发生,应向灾民发放饮水清洁剂.你认为下列物质最适宜做饮水清洁剂的是( )
| A. | Ca(ClO)2、KAl(SO4)2﹒12H2O | B. | Cl2、KAl(SO4)2﹒12H2O | ||
| C. | H2O、SO2 | D. | H2SO4、亚硫酸钠 |
2.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的B电子排布图如图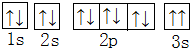 ,违背了泡利原理.
,违背了泡利原理.
(3)F位于周期表中第四周期、ⅦB族、d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图
 ,违背了泡利原理.
,违背了泡利原理.(3)F位于周期表中第四周期、ⅦB族、d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
9.近期,一美国科学家宣称其发现了第116号元素283X,这一成果极大地鼓舞了科学届发现新元素的信心.下列关于这种新元素的推测正确的是( )
| A. | 它位于元素周期表的第六周期第ⅥA族 | |
| B. | 它可能是非金属元素 | |
| C. | 它能与氢气化合生成稳定的气态氢化物 | |
| D. | 它的中子数比质子数大51 |
6.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 30g乙烷含有的共价键数目为8NA | |
| B. | 标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| C. | 1mol甲基含10 NA个电子 | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
7.在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A. | 室温下$\frac{{K}_{W}}{c({H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Mg2+、NO3-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | |
| C. | 加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3- | |
| D. | 在H+、Na+、SO42-浓度均为0.1 mol•L-1的溶液中:K+、SiO32-、Cl-、CH3COO- |