题目内容
【题目】完成下列问题:
I.(1)某学习小组用0.80 mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸。
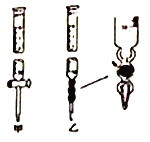
①滴定管如图所示,用 (填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸溶液。
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该未知盐酸的浓度为_______________(保留两位有效数字)。
(2)若用酚酞作指示剂,达到滴定终点的标志是____________________。
(3)造成测定结果偏高的操作可能是__________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数
II.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组设计了如下方案:
①称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。
②用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
(1)用含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式:_____________。
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果________(选填“偏高”、“偏低”或“无影响”)。
【答案】Ⅰ.(1)①甲 ②0.92 mol·L-1 (2)无色变粉红色且30 s不变色 (3)B C
Ⅱ.(1)Fe3++3SCN — ![]() Fe(SCN)3 (2)偏高
Fe(SCN)3 (2)偏高
【解析】
试题分析:I(1)①盐酸呈酸性,故应用酸式滴定管盛装待测盐酸,选甲。②分析表中数据知平均消耗V(NaOH)=(23.00+23.10+22.90)÷3=23.00mL,根据化学方程式:HCl+NaOH=NaCl+H2O知c(HCl)×20.00mL=0.80mol/L×23.00mL,解得c(HCl)=0.92 mol·L-1。
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变粉红色且30 s不变色。
(3)A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差,错误;B.碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(HCl)偏高,正确;C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,标准氢氧化钠溶液的浓度偏低,所用体积偏大,测定c(HCl)偏高,正确;D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,测定c(HCl)偏低,错误,选BC。
II(1)反应过程中用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,滴入最后一滴后,硫氰根离子与Fe3+反应:Fe3++3SCN — ![]() Fe(SCN)3溶液由无色变为血红色,且半分钟内不变色。(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高。
Fe(SCN)3溶液由无色变为血红色,且半分钟内不变色。(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】元素A的各级电离能数据如下:
I1 | I2 | I3 | I4 | I5 | I6 | |
I/(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A常见价态是( )
A. +1 B. +2 C. +3 D. +4