题目内容
【题目】甲酸钙用途广泛,可用于高硫烟气脱硫助剂,也可作为制备草酸的中间体.据最新文献,氢氧化钙碳基化合成甲酸钙的反应如下:
![]() 反应1
反应1
(1)反应体系中存在以下两个竞争反应
![]() 反应2
反应2
![]() 反应3
反应3
![]() 二氧化碳与氢气直接合成甲酸的热化学反应方程式为 ______ .
二氧化碳与氢气直接合成甲酸的热化学反应方程式为 ______ .
![]() 为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和 ______
为了更有利于生成甲酸钙,应选择的反应条件是较低的温度和 ______ ![]() 填编号
填编号![]() .
.
A.催化剂![]() 低压
低压![]() 高压
高压
(2)如图1是反应2和反应3,lnK与温度T的关系;同一条件时反应2的K ______ ![]() 填“大于”或“小于”
填“大于”或“小于”![]() 反应3的K,这对于 ______
反应3的K,这对于 ______ ![]() 填“反应2”或“反应3”
填“反应2”或“反应3”![]() 不利的.
不利的.
(3)以氢氧化钙初始密度为![]() 、CO的分压为
、CO的分压为![]() 条件下催化反应,以氢氧化钙转化率
条件下催化反应,以氢氧化钙转化率![]() 为坐标,时间为横坐标得到如图2;
为坐标,时间为横坐标得到如图2;

![]() 根据图象选择合适的反应温度 ______ ;理由是 ______ .
根据图象选择合适的反应温度 ______ ;理由是 ______ .
![]() 当
当![]() 为
为![]() 时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有 ______
时,产物中甲酸钙与碳酸钙的质量比为50:1,氢氧化钙有 ______ ![]()
【答案】![]() AC 小于 反应2 453K 温度越高,反应速率越快,时间越短,但463K时,增幅不明显,能耗反而增多,故选择453K
AC 小于 反应2 453K 温度越高,反应速率越快,时间越短,但463K时,增幅不明显,能耗反而增多,故选择453K ![]()
【解析】
![]() 根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
![]() 使用催化剂可以加快反应速率,正反应为气体体积减小的反应,增大压强有利于甲酸钙生成;
使用催化剂可以加快反应速率,正反应为气体体积减小的反应,增大压强有利于甲酸钙生成;
![]() 属于增函数,lnK值越大,K值越大,由图可知,相同条件下反应2的lnK更小,故反应2的平衡常数小于反应3,反应2为放热反应,反应3为吸热反应,升高温度有利于反应3向正反应方向移动;
属于增函数,lnK值越大,K值越大,由图可知,相同条件下反应2的lnK更小,故反应2的平衡常数小于反应3,反应2为放热反应,反应3为吸热反应,升高温度有利于反应3向正反应方向移动;
![]() 温度高反应速率快,但463K时,图象与453K时几乎重合,反应速率增快不明显,应选择453K;
温度高反应速率快,但463K时,图象与453K时几乎重合,反应速率增快不明显,应选择453K;
![]() 设甲酸钙质量为130g,则碳酸钙质量为
设甲酸钙质量为130g,则碳酸钙质量为![]() ,计算各自物质的量,由钙元素守恒,转化甲酸钙的氢氧化钙与甲酸钙物质的量相等,由钙元素守恒计算氢氧化钙的总物质的量,进而计算转化为甲酸钙的氢氧化钙占有的质量分数.
,计算各自物质的量,由钙元素守恒,转化甲酸钙的氢氧化钙与甲酸钙物质的量相等,由钙元素守恒计算氢氧化钙的总物质的量,进而计算转化为甲酸钙的氢氧化钙占有的质量分数.
![]() 已知:Ⅰ
已知:Ⅰ![]()
Ⅱ![]()
根据盖斯定律,Ⅰ![]() Ⅱ可得:
Ⅱ可得:![]() ,
,
故答案为:![]() ;
;
![]() 使用催化剂可以加快反应速率,正反应为气体体积减小的反应,平衡向正反应方向移动,增大压强有利于甲酸钙生成,
使用催化剂可以加快反应速率,正反应为气体体积减小的反应,平衡向正反应方向移动,增大压强有利于甲酸钙生成,
故选:AC;
![]() 属于增函数,lnK值越大,K值越大,由图可知,相同条件下反应2的lnK更小,故反应2的平衡常数小于反应3,反应2为放热反应,反应3为吸热反应,升高温度有利于反应3向正反应方向移动,不利于反应2进行,
属于增函数,lnK值越大,K值越大,由图可知,相同条件下反应2的lnK更小,故反应2的平衡常数小于反应3,反应2为放热反应,反应3为吸热反应,升高温度有利于反应3向正反应方向移动,不利于反应2进行,
故答案为:小于;反应2;
![]() 温度越高,反应速率越快,时间越短,但463K时,图象与453K时几乎重合,反应速率增快不明显,消耗能源反而增多,应选择453K,
温度越高,反应速率越快,时间越短,但463K时,图象与453K时几乎重合,反应速率增快不明显,消耗能源反而增多,应选择453K,
故答案为:453K;温度越高,反应速率越快,时间越短,但463K时,增幅不明显,能耗反而增多,故选择453K;
![]() 设甲酸钙质量为130g,其物质的量为1mol,则碳酸钙质量为
设甲酸钙质量为130g,其物质的量为1mol,则碳酸钙质量为![]() ,其物质的量为
,其物质的量为![]() 由钙元素守恒,可知转化甲酸钙的氢氧化钙为1mol,氢氧化钙的总物质的量为
由钙元素守恒,可知转化甲酸钙的氢氧化钙为1mol,氢氧化钙的总物质的量为![]() ,故转化为甲酸钙的氢氧化钙占总的
,故转化为甲酸钙的氢氧化钙占总的![]() ,
,
故答案为:![]() .
.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
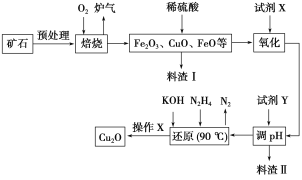
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
S(l)+2CO2(g) △H1= - 37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)= _______;在20min时,温度T2下,该反应的化学平衡常数为________________。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_____________(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的________(填序号)。
CH3OH(g)反应达到平衡状态的________(填序号)。
a.2v正(H2)=v逆(CH3OH) b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2 d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
2NO2的正反应速率v正=k1Cm(NO)Cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
组别 | 起始浓度/mol·L-1 | 初始速率/ mol·L-1·S-1 | |
NO | O2 | ||
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0.0125 | 31.92×10-3 |
则k1=____, m =_____, n =_____。