题目内容
【题目】雾霾成因有多种,其中燃煤过程中产生的二氧化硫、氮氧化物以及可吸入颗粒物是山西冬季雾霾的主要组成。治霾迫在眉睫,利在千秋。
I.脱氮
已知: ①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1
②2NO(g)+O2===2NO2(g) ΔH2=-116.5kJ·mol-1
③N2(g)+O2(g)===2NO(g) ΔH3=+180.5kJ·mol-1
(1)则燃煤所产生的废气中NO2 与CO 转化成无污染气体的热化学方程式为:________________________________。
(2)若1molN2(g)1mo1O2(g)分子中化学键断裂时分别吸收946kJ、498KJ的能量,则1mo1NO(g) 分子中化学键断裂时需要吸收的能量为_____________________KJ。
Ⅱ.脱硫的反应原理2CO(g) +SO2(g)![]() 2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
(1)若在一定温度下,将总物质的量为3 mol的CO(g)和SO2(g) 以不同比例充入2 L的恒容容器中,结果如图所示。a、b分别表示SO2、CO的平衡转化率的变化,c表示平衡体系中CO2的体积分数的变化。
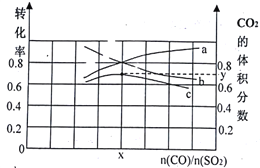
由图计算x=__________;CO2的体积分数y=_________(精确到0.01),该温度下的平衡常数K=_____。
(2)在T1℃下,将CO与SO2按体积比为5∶4充入一恒压密闭容器中,此时容器体积为0.1V L。
①下列能判断该反应达到化学平衡状态的是_____________。
a.S(l)的质量不变
b.K不变
c.容器中气体的平均相对分子质量不变
d.2v正(SO2)= v正(CO2)
e.Q值不变
②压强一定的条件下,在不同温度下进行反应,测得容器的体积变化如图所示:
已知: n1≠n2
温度(℃) | 初始投入总量 | 初始投料v (CO) /v (SO2) | 初始体积(L) | 平衡体积(L) |
T1 | n1 | 5∶4 | 0.1v | 0.07v |
T2 | n2 | 5∶4 | 0.3v | 0.22v |
求:T1温度时,SO2的平衡转化率为_____%;
比较大小,T1___T2(填“>”、“<”、“=”),解释原因____________________。
【答案】 4CO(g)+2NO2(g)= 4CO2(g) +N2(g) ΔH=-1196 kJ·mol-1 631.75 kJ 2 0.73 160 ac 67.5 < ΔH<0,且SO2的转化率T2时的小于T1时的
【解析】I.本题考查热化学反应方程式的计算,(1)NO2与CO反应方程式为2NO2+4CO=4O2+N2,①×2-②-③得出:4CO(g)+2NO2(g)= 4CO2(g) +N2(g) ΔH=-1196 kJ·mol-1;(2)根据△H=反应物键能总和-生成物键能总和,令NO的键能为xkJ·mol-1,△H=946+498-2x=180.5kJ·mol-1,解得x=631.75kJ·mol-1;II.本题考查化学平衡的计算、化学平衡状态的判断,(1)根据反应方程式,当CO与SO2投料比等于化学计量数之比时,两者的转化率相等且CO2的体积分数时最大的,即x=2,2CO(g)+SO2(g) ![]() 2CO2(g)+S(l)
2CO2(g)+S(l)
起始 1mol/L 0.5 mol/L 0 mol/L
变化 0.8 mol/L 0.4 mol/L 0.8 mol/L
平衡 0.2 mol/L 0.1 mol/L 0.8 mol/L,CO2的体积分数=0.8/(0.2+0.1+0.8)=0.73,根据化学平衡常数的表达式K=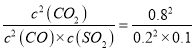 =160;(2)①a、当S的质量保持不变,说明反应达到平衡,故a正确;b、K只受温度的影响,温度不变,则K不变,因此K不变,不能说明反应达到平衡,故b错误;c、M=m/n,S为液态,气体质量减小,气体物质的量减小,因此当气体平均摩尔质量不变,说明反应达到平衡,故c正确;d、用不同物质的化学反应速率,表示反应达到平衡,要求反应方向一正一逆,v正(SO2)、v正(CO2)都是向正反应方向进行,因此2v正(SO2)= v正(CO2)不能表明反应达到平衡,故d错误;e、△H只与始态和终态有关,因此Q不变,不能说明反应达到平衡,故e错误;②SO2的体积为4×0.1/9L,
=160;(2)①a、当S的质量保持不变,说明反应达到平衡,故a正确;b、K只受温度的影响,温度不变,则K不变,因此K不变,不能说明反应达到平衡,故b错误;c、M=m/n,S为液态,气体质量减小,气体物质的量减小,因此当气体平均摩尔质量不变,说明反应达到平衡,故c正确;d、用不同物质的化学反应速率,表示反应达到平衡,要求反应方向一正一逆,v正(SO2)、v正(CO2)都是向正反应方向进行,因此2v正(SO2)= v正(CO2)不能表明反应达到平衡,故d错误;e、△H只与始态和终态有关,因此Q不变,不能说明反应达到平衡,故e错误;②SO2的体积为4×0.1/9L,
2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △V
2CO2(g)+S(l) △V
1 1
0.03v (0.1v-0.07v),因此SO2的转化率为 =67.5%;根据上述分析,T2时,SO2的转化率为60%,因为正反应时放热反应,根据勒夏特列原理,升高温度,向吸热反应方向进行,即T1<T2。
=67.5%;根据上述分析,T2时,SO2的转化率为60%,因为正反应时放热反应,根据勒夏特列原理,升高温度,向吸热反应方向进行,即T1<T2。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案