题目内容
【题目】下列化学方程式或离子方程式书写错误的是
A. 从海带中提取碘:H2O2 + 2I—+ 2H+ = 2H2O + I2
B. 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br—CH2Br
C. 苯与溴的反应:
D. 金属锂在空气中加热:2Li+O2 ![]() Li2O2
Li2O2
【答案】D
【解析】
A.从海带中提取碘,可用双氧水来氧化I-,发生的离子反为H2O2 + 2I—+ 2H+ = 2H2O + I2,故A项中离子方程式正确;B.乙烯使溴的四氯化碳溶液褪色是因为乙烯与溴发生了加成反应:CH2=CH2+Br2 → CH2Br—CH2Br,故B项中方程式正确;C. 苯与溴发生的是取代反应: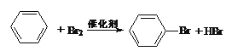 ,故C项正确;D. 金属锂的活泼性不如金属钠,故在空气中加热发生的反应为:4Li+O2
,故C项正确;D. 金属锂的活泼性不如金属钠,故在空气中加热发生的反应为:4Li+O2 ![]() 2Li2O,故D中方程式错误;答案选D。
2Li2O,故D中方程式错误;答案选D。

【题目】雾霾成因有多种,其中燃煤过程中产生的二氧化硫、氮氧化物以及可吸入颗粒物是山西冬季雾霾的主要组成。治霾迫在眉睫,利在千秋。
I.脱氮
已知: ①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1
②2NO(g)+O2===2NO2(g) ΔH2=-116.5kJ·mol-1
③N2(g)+O2(g)===2NO(g) ΔH3=+180.5kJ·mol-1
(1)则燃煤所产生的废气中NO2 与CO 转化成无污染气体的热化学方程式为:________________________________。
(2)若1molN2(g)1mo1O2(g)分子中化学键断裂时分别吸收946kJ、498KJ的能量,则1mo1NO(g) 分子中化学键断裂时需要吸收的能量为_____________________KJ。
Ⅱ.脱硫的反应原理2CO(g) +SO2(g)![]() 2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
2CO2(g) +S(1) ΔH=-QkJ·mol-1(Q>0)
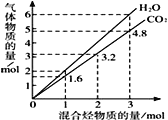
(1)若在一定温度下,将总物质的量为3 mol的CO(g)和SO2(g) 以不同比例充入2 L的恒容容器中,结果如图所示。a、b分别表示SO2、CO的平衡转化率的变化,c表示平衡体系中CO2的体积分数的变化。
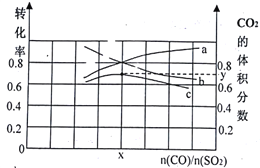
由图计算x=__________;CO2的体积分数y=_________(精确到0.01),该温度下的平衡常数K=_____。
(2)在T1℃下,将CO与SO2按体积比为5∶4充入一恒压密闭容器中,此时容器体积为0.1V L。
①下列能判断该反应达到化学平衡状态的是_____________。
a.S(l)的质量不变
b.K不变
c.容器中气体的平均相对分子质量不变
d.2v正(SO2)= v正(CO2)
e.Q值不变
②压强一定的条件下,在不同温度下进行反应,测得容器的体积变化如图所示:
已知: n1≠n2
温度(℃) | 初始投入总量 | 初始投料v (CO) /v (SO2) | 初始体积(L) | 平衡体积(L) |
T1 | n1 | 5∶4 | 0.1v | 0.07v |
T2 | n2 | 5∶4 | 0.3v | 0.22v |
求:T1温度时,SO2的平衡转化率为_____%;
比较大小,T1___T2(填“>”、“<”、“=”),解释原因____________________。