题目内容
【题目】已知A、F为金属单质,C是淡黄色粉末,M有磁性,回答下题。
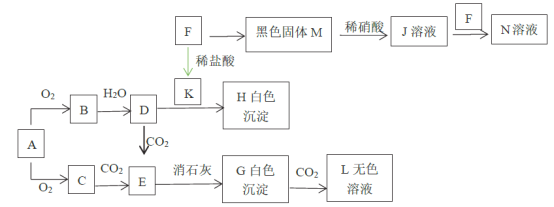
已知:2Na2O2+2CO2=2Na2CO3+O2
(1)写出下列物质的化学式。C____________L_______
(2)用玻璃棒蘸取少量无水CuSO4与熔化的A接触,瞬间产生耀眼的火花,同时有红色物质生成,写出该反应的化学反应方程式__________,在该反应中,氧化剂是____________。
(3)已知氧化性:HNO3>Fe3+,稀硝酸的还原产物是NO,写出固体M与稀硝酸反应的离子方程式________。
(4)写出J与F混合的化学反应方程式:_______。
(5)写出L与足量的D反应的离子方程式:__________。
(6)向1 L 0.2 mol/L的D溶液中通入CO2气体3.36 L(标准状况),所得溶液中的溶质是__________。
【答案】Na2O2 Ca(HCO3)2 2Na+ CuSO4=== Cu+ Na2SO4 CuSO4 3Fe3O4+28H++NO3- ===9Fe3++NO↑+14H2O 2FeCl3+ Fe === 3FeCl2 Ca2++ 2HCO3-+ 2OH- === CaCO3↓+ CO32- +2H2O Na2CO3、NaHCO3
【解析】
A为金属单质,与O2生成的C是淡黄色粉末,可推断A为Na,C为Na2O2,根据已知:2Na2O2+2CO2=2Na2CO3+O2,可知E为 Na2CO3,白色沉淀G为CaCO3,CaCO3和CO2反应生成的L为Ca(HCO3)2;F为金属单质,M有磁性,可推断F为Fe,M为Fe3O4,K为FeCl2,Fe3O4和HNO3反应生成Fe(NO3)3,Fe(NO3)3和Fe反应生成Fe(NO3)2;由A为Na,C为Na2O2,可推断B为Na2O,D为NaOH,NaOH和FeCl2反应生成的H是Fe(OH)2。可在此推导基础上解各小题。
(1)根据推导结果可知,淡黄色粉末C是Na2O2,CaCO3和CO2反应生成的L为Ca(HCO3)2。答案为:Na2O2;Ca(HCO3)2
(2)A是Na,反应生成的红色物质是Cu,则该反应的化学反应方程式为:2Na+ CuSO4=== Cu+ Na2SO4,Cu元素化合价降低,所以CuSO4是氧化剂。答案为:2Na+ CuSO4=== Cu+ Na2SO4;CuSO4
(3)M是Fe3O4,可表示为FeOFe2O3,+2价Fe和+3价Fe个数比为1:2;根据已知,氧化性:HNO3>Fe3+,可知+2的Fe能被稀硝酸氧化为Fe3+并失去1个电子;还原产物是NO得到3个电子,根据电子守恒,Fe3O4和NO应为3:1,再根据电荷守恒、质量守恒,可写出固体M与稀硝酸反应的离子方程式为:3Fe3O4+28H+ +NO3- ===9Fe3+ + NO↑+14H2O。答案为:3Fe3O4+28H+ +NO3- === 9Fe3+ +NO↑+14H2O
(4)J是FeCl3,F是Fe,二者混合反应生成FeCl2,化学反应方程式为:2FeCl3+ Fe === 3FeCl2。答案为:2FeCl3+ Fe === 3FeCl2
(5)L是Ca(HCO3)2,D是NaOH,二者反应可理解为:先HCO3- + OH- === CO32- + H2O,继而Ca2++ CO32- === CaCO3↓;由于NaOH足量,所以Ca(HCO3)2完全反应,即,参加反应的Ca2+和HCO3-比值为1:2,则该反应的离子方程式为:Ca2++ 2HCO3- + 2OH- === CaCO3 ↓+ CO32- +2H2O。答案为:Ca2++ 2HCO3- + 2OH- === CaCO3↓+ CO32- +2H2O
(6)D(NaOH)的物质的量为1 L×0.2 mol/L=
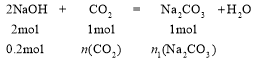
n(CO2)= 0.1 mol,n1(Na2CO3) = 0.1 mol,
再:
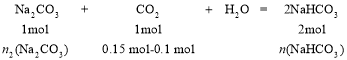
n2(Na2CO3)= 0.05 mol,n(NaHCO3)= 0.1 mol
Na2CO3剩余0.1 mol-0.05 mol=0.05 mol,所以所得溶液中的溶质是0.05 mol Na2CO3和0.1 mol NaHCO3。答案为:Na2CO3、NaHCO3