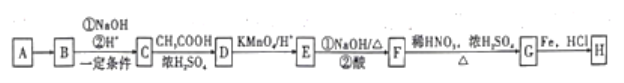
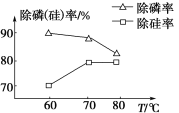
题目内容
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
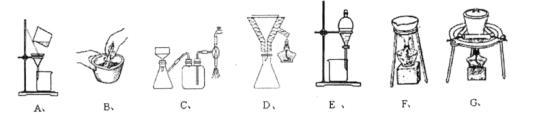
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
【答案】2Cu2++4HCO3-=Cu(OH)2·CuCO3↓+3CO2↑+H2O 升高温度能加快反应,但温度过高导致Cu(OH)2·CuCO3分解 AEG 关小水龙头,向布氏漏斗中加水至浸没晶体,使水缓慢通过晶体重复2-3次 80%
【解析】
(1)步骤(ⅰ)将研磨后混合物注入热水后,会观察到有大量气泡产生并有蓝色沉淀产生,可知除生成Cu(OH)2CuCO3外,还有CO2 气体生成,结合电荷守恒和原子守恒即可写出发生反应的离子方程式;
(2)碱式碳酸铜不稳定,温度过高容易分解;
(3)根据步骤(ⅰ)与步骤(ⅱ)中制备醋酸铜的操作步骤选用需要的仪器;
(4)根据减压过滤操作分析洗涤晶体操作方法;
(5)根据n=![]() 计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜 的物质的量,再根据反应Cu(OH)2CuCO3+4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率。
计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜 的物质的量,再根据反应Cu(OH)2CuCO3+4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率。
(1)步骤(ⅰ)将研磨后混合物注入热水后,生成Cu(OH)2CuCO3和CO2,发生反应的离子方程式为2Cu2++4HCO3-=Cu(OH)2CuCO3↓+3CO2↑+H2O;
(2)温度升高能加快反应速率,但温度过高,就会导致Cu(OH)2CuCO3分解,则制备Cu(OH)2CuCO3需在热水中进行反应,且温度需控制在60℃左右;
(3)根据醋酸铜的制备步骤可知,固体研碎应在研钵中进行,倾析法过滤不需要过滤装置A,需要减压过滤需要装置C、趁热过滤需要装置D,和蒸发装置需要装置 F,没有使用到分液装置和固体加热分解装置,则需要的装置有A、E、G;
(4)利用减压抽滤装置洗涤晶体,具体操作是关小水龙头,向布氏漏斗中加水至 浸没晶体,使水缓慢通过晶体重复2-3次;
(5)12.5g硫酸铜晶体的物质的量n(CuSO4)=![]() =0.05mol, 9.5g碳酸氢钠的物质的量n(NaHCO3)=
=0.05mol, 9.5g碳酸氢钠的物质的量n(NaHCO3)=![]() ≈0.113mol, 根据反应2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4 +H2O可知,NaHCO3,反应生成的碱式碳酸铜的物质的量等于硫酸铜晶体的物质的量为0.05mol,根据反应Cu(OH)2CuCO3 +4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑可知,生成甲酸铜的物质的量也为0.05mol, 所以反应产生甲酸铜的产率为:
≈0.113mol, 根据反应2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4 +H2O可知,NaHCO3,反应生成的碱式碳酸铜的物质的量等于硫酸铜晶体的物质的量为0.05mol,根据反应Cu(OH)2CuCO3 +4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑可知,生成甲酸铜的物质的量也为0.05mol, 所以反应产生甲酸铜的产率为:![]() ×0.05mol×100%=80%。
×0.05mol×100%=80%。

 名校课堂系列答案
名校课堂系列答案