题目内容
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)写出A与D以1∶1的原子个数比形成的化合物的电子式:______________。F的离子结构示意图为_______________________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、D、E三种元素形成的化合物为____________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为________________________________。
(4)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为_________________________________。
【答案】![]()
![]() )共价 离子 OH-+HCO3-=CO32-+H2O 2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1
)共价 离子 OH-+HCO3-=CO32-+H2O 2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1
【解析】
短周期主族元素A、B、C、D、E、F的原子序数依次增大,由B形成的化合物种类繁多,可以知道B为C元素;根据C、D为空气中含量最多的两种元素,且C、D的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,A的电子层数为13-2-2-2-3-3=1,则A为H元素;以此分析解答。
(1)由上述分析可知:A为H元素,D为O元素,所以A与D以1∶1的原子个数比形成的化合物为H2O2,其电子式:![]() 。由F为Cl元素,所以F的离子结构示意图为
。由F为Cl元素,所以F的离子结构示意图为![]() ;所以本题答案:
;所以本题答案:![]() ;
; ![]() ;
;
(2)由上述分析可知;B为C元素,D为O元素,B、D形成的化合物为CO2属于共价化合物,分子中存在共价键。由A为H元素,D为O元素,E为Na,A、D、E三种元素形成的化合物为氢氧化钠,属于离子化合物。所以本题答案:共价;离子;
(3)由A为H元素,B为C元素,D为O元素,E为Na,化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。所以甲、乙可能为Na 2CO3、NaOH、NaHCO3中的两种,且甲、乙两种物质能反应,所以甲、乙中一个为NaOH,一个为NaHCO3,两者反应的离子方程式为OH-+HCO3-=CO32-+H2O;答案:OH-+HCO3-=CO32-+H2O。
(4)由C为N元素,A为H元素,D为O元素,所以化合物C2A4为N2H4,C2D4的化学式为N2O4, 1mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,所以该反应的热化学方程式为2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1,答案:2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1

【题目】为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
①下列有关说法正确的是_________。
A.在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D.恒温恒压时,充入CH4有利于提高氮氧化物的转化率
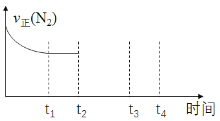
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)![]() N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) | K1=1×1030 | △H=-180.5kJ/mol |
反应II:2CO2 (g) | K2=4×10-92 | △H= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
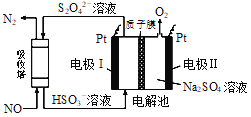
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_________________________。