题目内容
【题目】按要求完成下列问题:
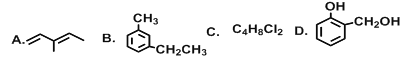

(1)G在同一直线上的碳原子数为___________;
(2)上述有机物互为同分异构体的是__________(填字母);
(3)A的系统命名为______________,它与Cl2以1:1比例反应时产物有_________种;
(4)上述有机物能与金属钠反应的是_________(填字母),能与碳酸氢钠反应的是______(填字母),B与酸性高锰酸钾反应的产物是______________(填结构简式);
(5)C的同分异构体有________种。
【答案】4EF3-甲基-1,3-戊二烯3DEE![]() 9
9
【解析】
(1)由乙炔分子的空间构型可知G分子中有四个碳原子在同一条直线上,故答案为:4;
(2)上述有机物中E和F的结构不同,分子式均为:C7H6O2,故答案为:EF;
(3)A分子中含有两个双键,其系统名称为:3-甲基-1,3-戊二烯,故答案为:3-甲基-1,3-戊二烯;
(4)D分子中含有羟基,E分子中含有羧基,能与金属钠反应;E分子中含有有羧基,能与碳酸氢钠反应;B为苯的同系物,被氧化生成![]() ;故答案为: DE、 E、
;故答案为: DE、 E、![]() ;
;
(5)C的分子结构中含有两个碳原子,碳链有两种连接方式,丁基有四种结构,其一代物有四种,然后再移动另一个氯原子的位置,共有9种不同的结构,故答案为:9。

【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。