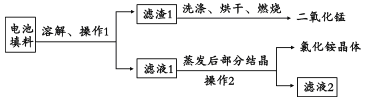
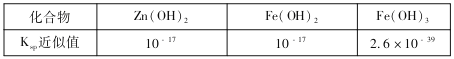
题目内容
【题目】(1)用离子方程式解释:盛纯碱溶液的试剂瓶有玻璃塞,时间久了不易打开_____________。
(2)某同学想把AlCl3(aq)和Na2S(aq)混合制取A12S3,但最后得到一种白色絮状沉淀,而且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式___________________。
(3)同温度下,具有相同 NH4+浓度的 NH3 ·H2O, NH4CI,CH3COONH4, NH4Fe(SO4)2 中,溶质浓度由大到小的顺序为_____________。
(4)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4C1溶液、盐酸和NaNO3溶液中的一种。己知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。则:B是 溶液,C是_____________。
【答案】⑴CO32-+H2O![]() HCO3-+OH-(1分)
HCO3-+OH-(1分)
SiO2+2OH-=SiO32-+H2O(1分)
⑵2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑(2分)
⑶①>③>②>④(2分)
⑷CH3COONa(2分)盐酸(2分)
【解析】
试题分析:(1)碳酸钠水解溶液显碱性,生成的氢氧根与二氧化硅反应生成黏性很强的硅酸钠,而不易打开,所以盛纯碱溶液的试剂瓶用玻璃塞,时间久了不易打开,有关反应的离子方程式为CO32-+H2O![]() HCO3-+OH-、SiO2+2OH-=SiO32-+H2O。
HCO3-+OH-、SiO2+2OH-=SiO32-+H2O。
(2)硫离子和铝离子水解相互促进生成氢氧化铝和H2S,反应的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。
(3)醋酸根水解显碱性,促进铵根水解。铁离子水解显酸性,抑制铵根水解,一水合氨是弱电解质,电离程度很小,则同温度下,具有相同 NH4+浓度的 NH3·H2O、NH4CI、CH3COONH4、NH4Fe(SO4)2 中,溶质浓度由大到小的顺序为①>③>②>④。
(4)醋酸钠中醋酸根水解,溶液显碱性。氯化铵中铵根水解,溶液显酸性。盐酸是一元强酸,溶液显酸性。硝酸钠是强酸强碱盐,溶液显中性。A、B的水溶液中水的电离程度相同,二者是能水解的盐。A、C溶液的pH相同,则A是氯化铵,B是醋酸钠,C是盐酸,D是硝酸钠。
应用 | 原理解释 |
热的纯碱溶液去污能力强 | 加热促进了盐的水解,氢氧根离子浓度增大 |
泡沫灭火器原理 | Al3+与HCO |
明矾净水 | 铝离子水解生成的氢氧化铝胶体可用来净水 |
物质提纯 | 除去氯化镁酸性溶液中的氯化铁,可以加入氧化镁或氢氧化镁反应掉部分H+,促进铁离子的水解,使Fe3+转化为氢氧化铁沉淀而除去 |
配制易水解的盐溶液 | 配制FeCl3、FeCl2、SnCl2、AlCl3等溶液时,常将它们溶于较浓的盐酸中,然后再加水稀释;目的是抑制铁离子、亚铁离子、锡离子、铝离子的水解 |
草木灰不能与铵态氮肥混合施用 | 铵根离子与碳酸根离子相互促进水解,使生成的氨气逸出而降低了氮肥肥效 |
硫化铝、氮化镁的制备 | 硫化铝、氮化镁在水溶液中强烈水解,只能通过单质间化合反应才能制得 |
判断盐溶液蒸干产物 | FeCl3溶液蒸干并灼烧产物为Fe2O3 |
盐溶液除锈 | 氯化铵溶液除去金属表面的氧化物,因为NH4+ 水解显酸性,与氧化物反应 |

【题目】利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
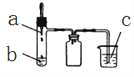
选项 | 实验试剂 | 实验现象 | 实验结论 | ||
a | b | c | |||
A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A. A B. B C. C D. D