题目内容
(12分)一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO (g) 十H2O (g) CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g) CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
发生如下反应:CO (g) 十H2O (g)
 CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 ________。
(3)t2℃时,化学反应CO (g) + H2O (g)
 CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃,判断依据是: (1)0.03 (2)① 0.5 ② 向右; 将H2O (g)浓度增加到0.286 mol·L-1(写增加H2O (g)浓度得1分) (3)< ; t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
(1)反应速率通常用单位时间内浓度的变化量来表示。根据图像可知,在0~4min内CO的浓度变化量是0.20mol/L-0.08mol/L=0.12mol/L,根据方程式可知CO2的浓度变化量也是0.12mol/L,所以反应速率是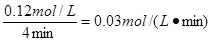 。
。
(2)①根据表中数据可知反应进行到3min时,物质的浓度就不再发生变化,反应达到平衡状态。所以平衡常数为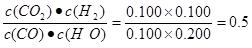 .
.
②反应在5min~6min间时,反应物的浓度降低,生成物的浓度增大,说明平衡向正反应方向移动。由于在第6min时CO的浓度减小,H2O的浓度增大,CO2的浓度也增大,说明改变的条件是增大了水蒸气的浓度,根据CO的变化量可知,在第5min时将H2O (g)浓度增加到0.266mol/L+0.116mol/L-0.096mol/L=0.286 mol·L-1。
(3)平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则此时平衡常数为2,根据(1)可计算出850℃时的平衡常数为1,即此时大于850℃的平衡常数,说明反应向正反应方向移动。又因为反应是放热反应,所以温度降低才能向正反应方向移动。
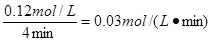 。
。(2)①根据表中数据可知反应进行到3min时,物质的浓度就不再发生变化,反应达到平衡状态。所以平衡常数为
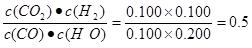 .
.②反应在5min~6min间时,反应物的浓度降低,生成物的浓度增大,说明平衡向正反应方向移动。由于在第6min时CO的浓度减小,H2O的浓度增大,CO2的浓度也增大,说明改变的条件是增大了水蒸气的浓度,根据CO的变化量可知,在第5min时将H2O (g)浓度增加到0.266mol/L+0.116mol/L-0.096mol/L=0.286 mol·L-1。
(3)平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则此时平衡常数为2,根据(1)可计算出850℃时的平衡常数为1,即此时大于850℃的平衡常数,说明反应向正反应方向移动。又因为反应是放热反应,所以温度降低才能向正反应方向移动。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为 ( )
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为 ( )
 3C(g)+D(g)的影响,且乙的压强大
3C(g)+D(g)的影响,且乙的压强大 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是 nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( ) C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )
C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )