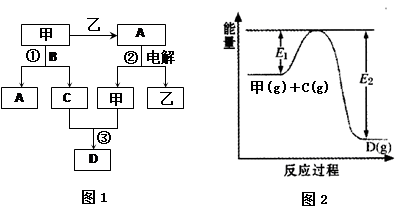
题目内容
把0.4molX气体和0.6molY气体混合于2L密闭容器中,一定条件下使它们发生如下反应:
2X(g)+Y(g)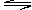 nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
(1)达到平衡时X的浓度为_________________
(2)化学方程式中的n值是_____________________;
2X(g)+Y(g)
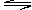 nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min(1)达到平衡时X的浓度为_________________
(2)化学方程式中的n值是_____________________;
[(1)0.1mol/L (2)1
考查可逆反应的有关计算。Z浓度变化来表示的反应平均速率为0.01mol/L·min,所以Z的物质的量是0.01mol/L·min×2L×5min=0.1mol。即W和Z的物质的量之比是2︰1,所以n等于1。根据2X(g)+Y(g)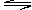 nZ(g)+2W(g)可知生成0.2molW,则消耗X是0.2mol,所以剩余X是0.4mol-0.2mol=0.2mol,其浓度为
nZ(g)+2W(g)可知生成0.2molW,则消耗X是0.2mol,所以剩余X是0.4mol-0.2mol=0.2mol,其浓度为 。
。
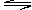 nZ(g)+2W(g)可知生成0.2molW,则消耗X是0.2mol,所以剩余X是0.4mol-0.2mol=0.2mol,其浓度为
nZ(g)+2W(g)可知生成0.2molW,则消耗X是0.2mol,所以剩余X是0.4mol-0.2mol=0.2mol,其浓度为 。
。
练习册系列答案
相关题目
 CO2(g)下列说法中错误的是 ( )
CO2(g)下列说法中错误的是 ( )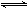 N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: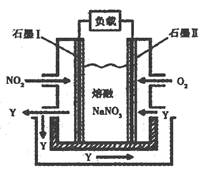
 CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0