题目内容
将70g过氧化钠和氧化钠的混合物跟98g水充分反应后.所得溶液的质量分数为50%,该溶液用一定浓度的盐酸400mL恰好完全中和。
![]() (1)计算原混台物中过氧化钠和氧化钠的质量:
(1)计算原混台物中过氧化钠和氧化钠的质量:
![]() (2)计算完全中和时所用盐酸的物质的量浓度是多少?
(2)计算完全中和时所用盐酸的物质的量浓度是多少?
![]()
解:
![]() (8分)(1)设原固体混合物中Na
(8分)(1)设原固体混合物中Na![]() 0
0![]() 和Na
和Na![]() 0的物质的量分别为n(×)和 n(Y)
0的物质的量分别为n(×)和 n(Y)
因为Na![]() O
O![]() →2NaOH Na
→2NaOH Na![]() O→ 2NaOH
O→ 2NaOH
![]() n(X) 2n(X) n(Y) 2n(Y)
n(X) 2n(X) n(Y) 2n(Y)
![]() 所以
所以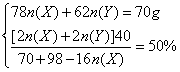
![]()
![]()
所以原固体混合物中有m(Na![]() O
O![]() )=0.5mol×78g/mol=39g(1分)
)=0.5mol×78g/mol=39g(1分)
m(Na![]() O)=0.5mol×62g/mol-31g(1分)
O)=0.5mol×62g/mol-31g(1分)
(2)由上面计算可知溶液中有NaOH的物质的量为2mol,听以完全中和所需HCI的物质的量也为2mol(2分)
所以盐酸溶液的物质的量浓度为:2mol/0.4L=5 m0l/L(2分)
答:原混合物中过氧化钠和氧化钠的质量39g和31g;完全中和时所用盐酸的浓度是5mol/L

练习册系列答案
相关题目