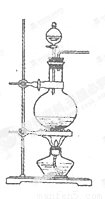
题目内容
将足量MnO2和200mL 12mol/L浓盐酸混合后缓缓加热,充分反应后,生成Cl2( )
| A、等于0.6 mol | B、小于0.6 mol | C、大于0.6 mol | D、以上结论都不正确 |
分析:依据二氧化锰与浓盐酸反应的化学方程式计算,注意稀盐酸与二氧化锰不反应.
解答:解:二氧化锰与浓盐酸反应的化学方程式为:MnO2+4HCl(浓
MnCl2+Cl2↑+2H2O,
12mol/L的浓盐酸200ml物质的量为2.4mol,与足量的MnO2反应,若HCl全部反应则生成O.6mol 氯气,实际上当反应进行到一定程度浓盐酸变稀,反应会停止,所以氯化氢不能全部反应,故生成Cl2的物质的量小于O.6mol,
故选B.
| ||
12mol/L的浓盐酸200ml物质的量为2.4mol,与足量的MnO2反应,若HCl全部反应则生成O.6mol 氯气,实际上当反应进行到一定程度浓盐酸变稀,反应会停止,所以氯化氢不能全部反应,故生成Cl2的物质的量小于O.6mol,
故选B.
点评:本题考查了实验室制备氯气的反应原理,题目简单,注意反应物浓度对反应的影响.

练习册系列答案
相关题目
 (2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示).
(2012?福建)实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图1所示). (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。