题目内容
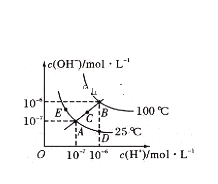
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
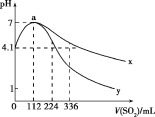
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
【答案】D
【解析】
A选项,由题图可知,a点表示通入SO2气体112mL(即0.005mol)时pH=7,说明SO2气体与H2S溶液恰好完全反应,溶液呈中性,a点之前为H2S过量,a点之后为SO2过量,溶液均呈酸性,故a点水的电离程度最大,故A正确;
B选项,由题图中曲线的起点可知,a点溶液呈中性,说明SO2气体与H2S溶液恰好完全反应,由此可知饱和H2S溶液中溶质的物质的量为0.01mol,c(H2S)=0.1mol/L,0.1mol/LH2S溶液电离出的c(H+)=10-4.1 mol/L,电离方程式为H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈
H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈![]() ≈10-7.2,故B正确;
≈10-7.2,故B正确;
C选项,当通入SO2气体336mL时,物质的量为0.015mol,反应后相当于溶液中的c(H2SO3)=0.1mol/L,因为H2SO3的酸性强于H2S,故此时溶液对应的pH应小于4.1,故曲线y代表继续通入SO2气体后溶液pH的变化,故C正确;
D选项,根据平衡常数表达式可知![]() =
=![]() ,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
综上所述,答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。