题目内容
【题目】已知水的电离平衡曲线如图所示:
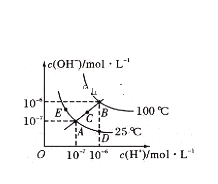
据图回答下列问题:
①图中A、B、C三点处![]() 的大小关系为____________________________________。
的大小关系为____________________________________。
②在A点处,温度不变时,往水中通入适量HCl气体,可以使体系从A点变化到________点。
③在B点处,0.01mol/L的NaOH溶液的pH=_______________。
④在B点处,0.5mol/L ![]() 溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
⑤在A点处,1g水中含有H+的个数为___________,水的电离平衡常数K与水的离子积![]() 关系为________________。
关系为________________。
【答案】B>C>A D 10 6 10-10NA或![]() K·c(H2O)=Kw或K·55.6=Kw
K·c(H2O)=Kw或K·55.6=Kw
【解析】
Kw只与温度有关,温度升高促进水的电离,Kw增大;A点变化到D点,溶液中c(H+)增大,c(OH-)减小;B点处Kw=10-12,根据c(H+)·c(OH-)=K(w),计算出c(H+),进而计算溶液的pH。
(1)根据图示,A点处Kw=10-14,B点处Kw=10-12,C点处Kw介于10-14和10-12之间,所以B>C>A;
(2)从A点变化到D点,溶液中c(H+)增大,c(OH-)减小,温度不变时往水中通入适量的HCl气体,溶液中c(H+)增大,水的电离平衡向逆反应方向移动,c(OH-)减小;
(3)B点处Kw=10-12,则c(H+)=![]() =10-10(mol/L),pH=10;
=10-10(mol/L),pH=10;
(4)B点处Kw=10-12,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,c(H+)=c(OH-),溶液呈中性,pH=6;
(5)1g水的体积为1×10-3L,A点处水的c(H+)=10-7mol/L,则氢离子的物质的量为1×10-3L×10-7mol/L=10-10mol,则氢离子的个数为10-10NA或![]() ;水的电离平衡常数为
;水的电离平衡常数为![]() ,水的离子积常数为
,水的离子积常数为![]() ,故K·c(H2O)=Kw或K·55.6=Kw。
,故K·c(H2O)=Kw或K·55.6=Kw。

 名校课堂系列答案
名校课堂系列答案【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D