题目内容
在氨水中存在下列电离平衡:NH3·H2O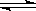 NH+OH-,下列情况能引起电离平衡向正向移动的有
( )
NH+OH-,下列情况能引起电离平衡向正向移动的有
( )
①加NH4Cl固体 ②加NaOH溶液 ③加HCl
④加CH3COOH溶液 ⑤加水 ⑥加热煮沸
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
【答案】
C
【解析】
试题分析:加入NH4Cl固体c(NH4+)增大,平衡逆向移动,加NaOH溶液c(OH-)增大,平衡逆向移动,加HCl, c(OH-)减小,平衡正向移动,加CH3COOH溶液,c(OH-)减小,平衡正向移动,加水平衡正向移动,加热氨气挥发,平衡逆向移动,所以答案选C。
考点:影响电离平衡的因素
点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。

练习册系列答案
相关题目
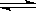 NH+OH-,下列情况能引起电离平衡向正向移动的有 ( )
NH+OH-,下列情况能引起电离平衡向正向移动的有 ( ) NH3·H2O
NH3·H2O  NH4++OH-,下列情况能引起电离平衡向正向移动的有
NH4++OH-,下列情况能引起电离平衡向正向移动的有 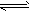 NH4++OH-,下列情况能引起电离平衡向正向移动的有
NH4++OH-,下列情况能引起电离平衡向正向移动的有