��Ŀ����
����ѧƽ���ƶ�ԭ����ͬ��Ҳ����������ƽ��
��1����֪�ڰ�ˮ�д�������ƽ�⣺NH3��H2O NH3��H2O
NH3��H2O  NH��OH��
NH��OH��
��ˮ�м���MgCl2����ʱ��ƽ������ �ƶ���OH����Ũ��
��Ũ��ˮ�м�������NaOH���壬ƽ���� �ƶ�����ʱ�����������ǣߣߣߣߣߣߣߣߣߣߣߡ�
��2���Ȼ���ˮ������ӷ���ʽΪ�ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣ����Ȼ�����Һ�м���̼��Ʒ�ĩ������̼������ܽ⣬��������ɫ���壬�����ӷ���ʽΪ�ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣ�ͬʱ�к��ɫ�������ɣ���ԭ����
��3����Mg(OH)2������Һ�м���NH4Cl��Һ������ ��ԭ
��Ϊ
����ij��Ԫ�� H2A �ĵ��뷽��ʽ�ǣ�H2A=H++HA��HA- A2-+H+���ش��������⣺
A2-+H+���ش��������⣺
��1��H2A�� ���ǿ����ʡ���������ʡ��ǵ���ʡ���
��2��Na2A ��Һ�� ������ԡ��������ԡ������ԡ����������ǣ������ӷ���ʽ��ʾ�� ��
��3��NaHA ��Һ�� ������ԡ��������ԡ������ԡ����������ǣ������ӷ���ʽ��ʾ�� ��
��4���� 0��1mol��L-1NaHA ��Һ�� pH=2���� 0��1mol��L-1 H2A��Һ�������ӵ����ʵ���Ũ�ȿ��� 0.11mol��L����������������������������ǣ� ��
��5��0��1mol��L NaHA��Һ�и�����Ũ���ɴ�С��˳���� ��
����1���� ��С �� �д̼����������
��2��Fe3+ + 3H2O Fe(OH)3 + 3H+ �� CaCO3 + 2H��=== Ca2+ + H2O +CO2��
Fe(OH)3 + 3H+ �� CaCO3 + 2H��=== Ca2+ + H2O +CO2��
̼�������H+ ,�ٽ��Ȼ�����ˮ�⣬ʹˮ�����Fe(OH)3��������,�γɺ��ɫ����
��3����Һ���ܽ⡡��Һ�д���ƽ�� Mg(OH)2 (S)  Mg2��(aq)+2OH��(aq) ,����NH4Cl��Һ�ᷢ��OH-+NH4+=NH3��H2O ������ƽ�����ܽⷽ���ƶ���������Һ���ܽ�
Mg2��(aq)+2OH��(aq) ,����NH4Cl��Һ�ᷢ��OH-+NH4+=NH3��H2O ������ƽ�����ܽⷽ���ƶ���������Һ���ܽ�
����1��ǿ�����
��2������ A2-+H2O HA-+OH-
HA-+OH-
(3)���� HA�� H++ A2��
H++ A2��
��4���� ��H2A��1�����������H+����HA-�ĵ���
��5��c(Na��)��c(HA��)>c(H��)>c(A2��)>c(OH��)
����

 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�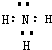
 HCO3-+OH-
HCO3-+OH-
 2SO3��g����
2SO3��g����