题目内容
【题目】在一密闭的2L的容器里装有4mol SO2和2mol O2,在一定条件下开始反应。2min末测得容器中共有5.2mol 气体,试计算:
(1)2min末SO3气体的物质的量浓度;
(2)2min内O2的平均反应速率v(O2);
(3)2min末SO2的转化率.
【答案】(1)2min末SO3气体的物质的量浓度为0.8mol/L,
(2)2min内O2的平均反应速率v(O2)为0.2mol/(L.min),
(3)2min末SO2的转化率为40%.
【解析】在一密闭的2L的容器里装有4mol SO2和2mol O2,根据c=![]() 可知SO2和O2开始时的浓度分别为2mol/L、1mol/L,设2min末SO2改变的浓度为xmol/L,则
可知SO2和O2开始时的浓度分别为2mol/L、1mol/L,设2min末SO2改变的浓度为xmol/L,则
2SO2 + O2 ![]() SO3
SO3
起始浓度(mol/L) 2 1 0
转化浓度(mol/L) x ![]() x
x
2min后浓度(mol/L) 2-x 1- ![]() x
x
则:(2-x+1-![]() +x)mol/L×2L=5.2mol ,解得:x=0.8mol/L
+x)mol/L×2L=5.2mol ,解得:x=0.8mol/L
(1)2min末SO3气体的物质的量浓度为:x=0.8mol/L;
(2)2min内O2的平均反应速率v(O2)=![]() =
=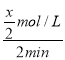 =
=![]() =0.2mol/(Lmin);
=0.2mol/(Lmin);
(3)2min末SO2的转化率=![]() ×100%=40%。
×100%=40%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目







