题目内容
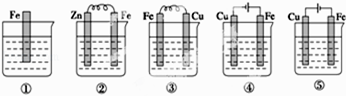
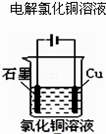
【题目】如图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02 mol电子通过,下列叙述中正确的是( )

A. 甲烧杯中A极上最多可析出铜0.64g
B. 乙烧杯中滴入酚酞试液,D极附近先变红
C. 甲烧杯中B极上电极反应式:4OH--4e-=2H2O+O2↑
D. 烧杯中C极上电极反应式为:4H++4e-=2H2↑
【答案】B
【解析】A.A极(阳极)反应式为4OH--4e-=2H2O+O2↑,生成氧气,不能析出铜,A错误;B.D极(阴极)反应式为4H++4e-=2H2↑,由于H+放电,打破了水的电离平衡,导致D极附近溶液呈碱性(有NaOH生成),D极附近先变红,B正确;C.甲烧杯中B极上电极反应式为:Cu2++2e-=Cu,C错误;D.烧杯中C极上电极反应式为2Cl--2e-=Cl2↑,D错误;答案选B。

【题目】下表列出了①~⑩十种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
请按要求回答下列问题。
(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是 ____________(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物中,酸性最强的化合物的分子式是:__________,与元素⑥的最高价氧化物对应水化物发生反应时的离子方程式为________________
(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有____________________________。