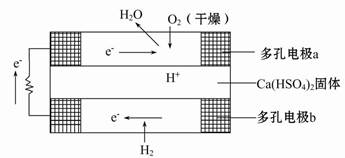
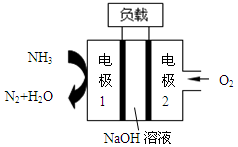
题目内容
如图为一原电池的结构示意图,下列说法中,不正确的是
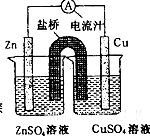

| A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| B.原电池工作时,Zn电极流出电子,发生氧化反应 |
| C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深 |
| D.盐桥中阳离子流向CuSO4溶液中 |
C
试题分析:A、锌的金属性强于铜,根据装置图可知,锌是负极,电极反应式为Zn-2e-=Zn2+。铜是正极,溶液中的铜离子得到电子,电极反应式为Cu2++2e-=Cu,所以总的反应式为Zn+Cu2+=Zn2++Cu,A正确;B、锌是负极,铜是正极,所以原电池工作时,Zn电极流出电子,发生氧化反应,B正确;C、铜是正极,溶液中的铜离子得到电子,发生还原反应,溶液颜色变浅,C不正确;D、原电池电子从负极沿导线传递到正极,所以原电池中阳离子向正极移动,则盐桥中阳离子流向CuSO4溶液中,D正确,答案选C。

练习册系列答案
相关题目
 2Li++H2↑
2Li++H2↑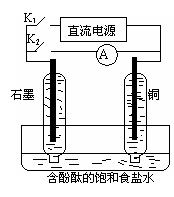
 Cl2↑+H2↑
Cl2↑+H2↑