题目内容
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如图所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
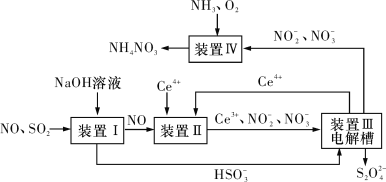
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是![]() 和
和![]() ,请写出生成等物质的量的
,请写出生成等物质的量的![]() 和
和![]() 时的离子方程式:__。
时的离子方程式:__。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的___(填“阳极”或“阴极”),同时在另一极生成![]() 的电极反应式为____。
的电极反应式为____。
(5)已知进入装置Ⅳ的溶液中![]() 的浓度为a g·L-1,要使1 m3该溶液中的NO
的浓度为a g·L-1,要使1 m3该溶液中的NO![]() 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数)。
【答案】14:33:12NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+阳极2H++2HSO3-+2e-===S2O42-+2H2O243
【解析】
(1)①化合价升高值=化合价降低值=转移电子数,根据N元素的化合价的变化来确定电子转移数目;②反应方程式中,系数之比等于物质的量之比,结合元素的化合价变化及原子守恒分析;(2)由原子守恒确定反应;(3)生成等物质的量的NO3-和NO2-时,Ce4+被还原为Ce3+,结合电子守恒、电荷守恒分析离子反应;(4)生成Ce4+为氧化反应,发生在阳极上;反应物是HSO3-被还原成S2O42-,得到电子;(5)NO2-的浓度为a gL-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:1000×(5-3)a/46,设消耗标况下氧气的体积是V,结合电子守恒进行计算。
(1)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是0.5mol×2=1mol;②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,只有N元素的化合价变化,氮气为氧化产物也是还原产物,由N原子守恒可知氧化产物与还原产物的质量比为8:6=4:3;(2)转换过程中发生反应的化学方程式为:CO+NOx→CO2+N2(未配平),若x=1.5,可利用“定一法”进行配平,把CO2的化学计量数定为1,则CO、NO1.5、N2前面的化学计量数分别为:1、![]() 、
、![]() .即3CO+2NO1.5→3CO2+N2,则化学方程式中CO2与N2的系数之比为3:1;(3)生成等物质的量的NO3-和NO2-时,Ce4+被还原为Ce3+,由电子守恒、电荷守恒可知,离子方程式为:2NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+;(4)生成Ce4+为氧化反应,发生在阳极上,连接电源正极,因此再生时生成的Ce4+在电解槽的阳极;反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2H++2HSO3-+2e-===S2O42-+2H2O;(5)NO2-的浓度为a gL-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:1000×(5-3)a/46,设消耗标况下氧气的体积是V,则失电子数目是:
.即3CO+2NO1.5→3CO2+N2,则化学方程式中CO2与N2的系数之比为3:1;(3)生成等物质的量的NO3-和NO2-时,Ce4+被还原为Ce3+,由电子守恒、电荷守恒可知,离子方程式为:2NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+;(4)生成Ce4+为氧化反应,发生在阳极上,连接电源正极,因此再生时生成的Ce4+在电解槽的阳极;反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2H++2HSO3-+2e-===S2O42-+2H2O;(5)NO2-的浓度为a gL-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:1000×(5-3)a/46,设消耗标况下氧气的体积是V,则失电子数目是:![]() ×2×(2-0),根据电子守恒:
×2×(2-0),根据电子守恒:![]() =
=![]() ×2×(2-0),解得V=243a。
×2×(2-0),解得V=243a。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2