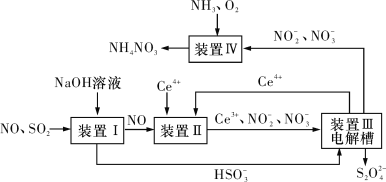
题目内容
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
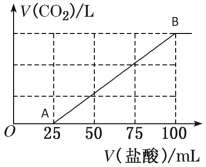
(1)A-B段的离子反应方程式为__________________________。
(2)原NaOH溶液的浓度为__________mol/L。
(3)通入CO2在标准状况下的体积为_______mL。
(4)所得溶液的溶质成分是_______________,其物质的量之比为_________。
【答案】H++HCO3-=H2O+CO2↑ 0.2 mol/L 336ml Na2CO3和NaHCO3 1:2
【解析】
向100mLNaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2═NaHCO3;AB段反应产生CO2气体,是由于发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,根据Na元素守恒,计算出溶液中NaOH的物质的量,结合c=![]() ,计算出NaOH的浓度;根据图像中发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗盐酸的物质的量,可计算出CO2的体积;利用Na2CO3与盐酸反应分步进行,首先是Na2CO3+HCl=NaHCO3+NaCl,然后是NaHCO3+HCl=CO2↑+NaCl+H2O,根据两步消耗盐酸的物质的量关系,结合图像中产生气体前后消耗HCl的体积多少判断溶液成分,并进一步计算各种成分的物质的量及其比值关系。
,计算出NaOH的浓度;根据图像中发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗盐酸的物质的量,可计算出CO2的体积;利用Na2CO3与盐酸反应分步进行,首先是Na2CO3+HCl=NaHCO3+NaCl,然后是NaHCO3+HCl=CO2↑+NaCl+H2O,根据两步消耗盐酸的物质的量关系,结合图像中产生气体前后消耗HCl的体积多少判断溶液成分,并进一步计算各种成分的物质的量及其比值关系。
(1)A-B段发生反应为NaHCO3+HCl=CO2↑+NaCl+H2O,其离子反应方程式为H++HCO3-=H2O+CO2↑;
(2)当产生气体达到最大值时,溶液为NaCl溶液,根据元素守恒,可得n(NaOH)=n(NaCl)=n(HCl)= 0.2 mol/L×0.1L=0.02mol,由于NaOH溶液的体积为100 mL,所以该溶液的浓度为c(NaOH)=![]() ;
;
(3)由图像可知发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,消耗HCl体积为75mL,其物质的量是n(HCl)= 0.2 mol/L×0.075L=0.015mol,则n(CO2)= n(HCl)=0.015mol,V(CO2)= 0.015mol×22.4L/mol=0.336L=336mL;
(4) 向100mLNaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2=Na2CO3+H2O或NaOH+CO2═NaHCO3;溶液的成分可能有四种情况,分别是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3。若是第一种情况,不产生气体消耗HCl体积大于产生气体消耗HCl的体积,与图像不符合;若是第二种情况,不产生气体消耗HCl体积等于产生气体消耗HCl的体积,与图像不符合;若是第四种情况,加入盐酸立刻产生气体,也与图像不符合;只有第三种情况,不产生气体消耗HCl体积小于产生气体消耗HCl的体积,与图像符合。假如该溶液中Na2CO3和NaHCO3的物质的量分别为x、y,则根据图像可知25mLHCl发生反应Na2CO3+HCl=NaHCO3+NaCl,n(Na2CO3)=n(HCl)=0.2mol/L×0.025L=0.005mol,75mL盐酸发生反应NaHCO3+HCl=CO2↑+NaCl+H2O,则n(NaHCO3)(总)= 0.2 mol/L×0.075L=0.015mol,其中有0.005mol Na2CO3与HCl反应产生,所以原溶液中含有NaHCO3的物质的量为0.015mol-0.005mol=0.010mol,故所得溶液中n(Na2CO3):n(NaHCO3)=0.005mol:0.010mol=1:2。

 高中必刷题系列答案
高中必刷题系列答案【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
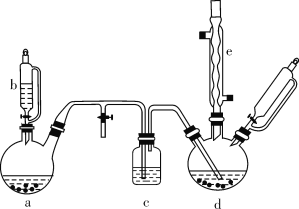
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。